ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 3180
а) Основность
Хинолин и изохинолин ведут себя как основания через неподеленную пару азота. В кислых средах они протонируются с образованием солей хинолиния и изохинолиния.
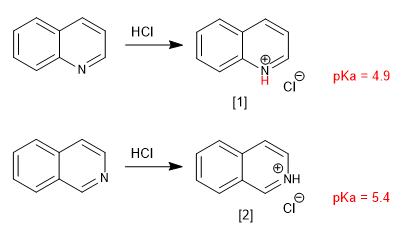
[1] Соль хинолиния
[2] Изохиниолиниевая соль
Заместители изменяют основность аналогично пиридину. Группы доноров увеличивают основность, а группы аттракторов уменьшают.
Подробнее: Реакции с неподеленной парой азота: хинолин и изохинолин
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 3485
Хинолин и изохинолин реагируют с электрофилами через бензольное кольцо (карбоцикл) из-за его более высокого электронного обогащения по сравнению с пиридиновым кольцом. Наиболее предпочтительными позициями являются 5 и 8.
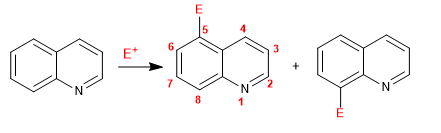
Подробнее: Реакция электрофильного замещения в хинолине и изохинолине
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2355
N-оксиды позволяют размещать электрофилы в положении 4 хинолина.
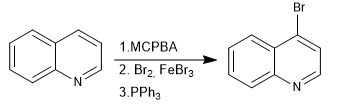
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2485
Реакция между галогенпроизводными хинолина и изохинолина с органолитами при низкой температуре приводит к обмену галогена на металл с образованием новых органолитов на кольце.
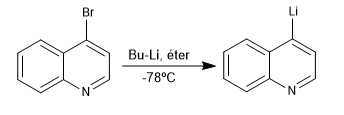
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2823
Нуклеофилы присоединяются к углероду 2 хинолина, хотя при определенных условиях он также может атаковать его углерод 4.
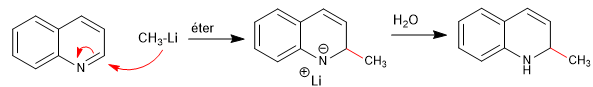
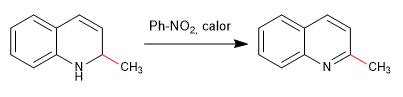
Подробнее: Нуклеофильное присоединение к хинолинам и изохинолинам
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 3462
Галогенхинолины в положении 2,4 очень легко вступают в реакции нуклеофильного замещения. Со своей стороны, изохинолин может дать эту реакцию только в положении 1. В этой реакции могут участвовать все нуклеофилы, способные давать S N 2 , плохие нуклеофилы, такие как вода или спирты, требуют подвода тепла.
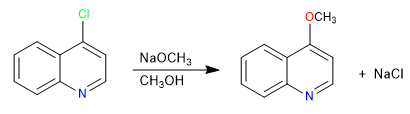
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2379
Пиридины с алкильными группами в положении 2,4 имеют кислые атомы водорода на углероде, примыкающем к пиридиновому кольцу.
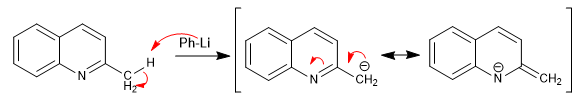
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 30518
В синтезе Скраупа анилин [1] реагирует с а,b -ненасыщенными карбонилами в кислой среде с образованием 1,2-дигидрохинолинов [3], которые при окислении превращаются в хинолины [4]. a,b-ненасыщенный карбонил может быть получен дегидратацией 1,2,3-пропантрия [2].
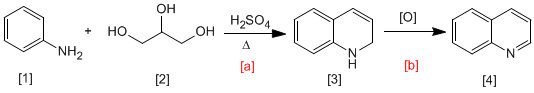
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 7872
В синтезе Конрада-Лимпаха хинолоны получают реакцией анилина с 3-кетоэфирами. В кинетических условиях получается 4-хинолон, а в термодинамических условиях - 2-хинолон.
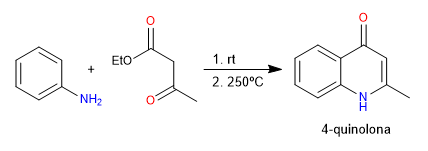
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2699
В синтезе Комба хинолины получают реакцией анилина с 1,3-дикарбонилами в присутствии кислотного катализа. На первой стадии образуется имин, который таутомеризуется в енамин, а, активируя ароматическое кольцо за счет отщепления пары азота. На последней стадии циклизация происходит за счет атаки бензола на карбонил цепи.
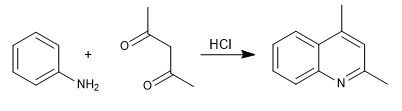
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2944
Синтез Фридлендера позволяет получить хинолины из орто-ацетилированного нитробензола и кетона. Синтез начинается с альдольной конденсации в основной среде. Восстановление нитрогруппы до аминогруппы делает возможной циклизацию с образованием имина.
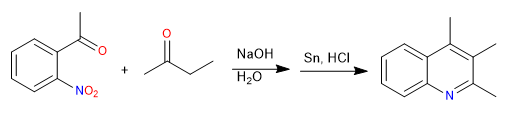
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2624
Реакция между 2-аминоэтилбензолом и алканоилгалогенидом в присутствии пиридина приводит к образованию амида. Амид превращается в электрофил Вильсмейера реакцией с окситрихлоридом фосфора. Циклизацию производят путем атаки бензола на указанный электрофил. В результате окончательного окисления образуется изохинолин.
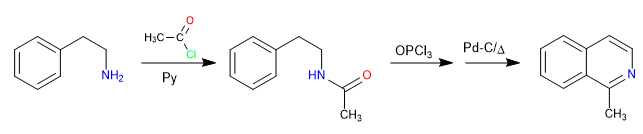
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2968
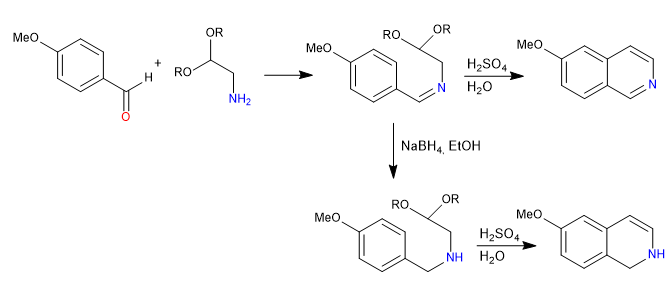
Пикте Шпенглера — реакция типа Манниха. На первой стадии электрофил Манниха образуется при взаимодействии амина с альдегидом в среде соляной кислоты. На заключительном этапе происходит циклизация путем атаки бензола на электрофил Манниха. Изохинолин получают после двойного окисления.
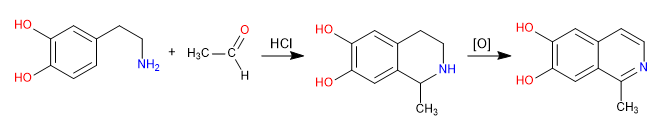
- Информация о материале
- Germán Fernández
- ХИНОЛИН И ИЗОХИНОЛИН ТЕОРИЯ
- Просмотров: 2545
Синтез Померанца-Фрича дает изохинолины путем взаимодействия бензальдегидов с защищенными α-аминоальдегидами в форме ацеталей. На первой стадии имин образуется в результате реакции между бензальдегидом и амином. На втором этапе ацеталь разрушают водным раствором серной кислоты, оставляя альдегид свободным, который циклизуется под воздействием бензола.