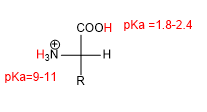
 La présence de groupements acides (-COOH) et basiques (-NH 2 ) confère aux acides aminés des propriétés acido-basiques caractéristiques.
La présence de groupements acides (-COOH) et basiques (-NH 2 ) confère aux acides aminés des propriétés acido-basiques caractéristiques.
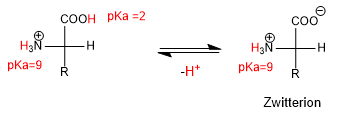
Dans les milieux acides forts, le groupe amino et le groupe acide sont protonés et l'acide aminé a la forme suivante :
Lorsque le pH augmente, le groupe le plus acide, H avec un pKa inférieur, est déprotoné, formant une espèce neutre appelée Zwitterion.
Lorsque l'acide aminé est en milieu basique, il perd le proton du groupe amino, donnant naissance à l'espèce déprotonée.
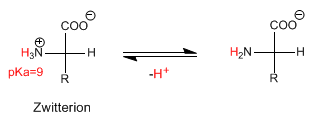
Le pH auquel la concentration de Zwitterion est maximale (l'acide aminé n'a pas de charge nette) est appelé pH isoélectrique ou point isoélectrique.
Une autre définition du point isoélectrique est : le pH auquel la concentration des espèces protonées et déprotonées s'égalise.
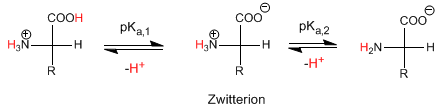
Le pH isoélectrique est calculé comme la moyenne des pK a,1 et pK a,2 , c'est-à-dire la moyenne des pKa des étages qui forment et décomposent le Zwitterion.