Dans la nature, les composés avec des cycles de cinq et six maillons sont très abondants. Cependant, les cycles à trois et quatre chaînons apparaissent très rarement dans les produits naturels.
Stabilité dans les cycloalcanes
Ces faits expérimentaux suggèrent la plus grande stabilité des cycles de cinq ou six membres par rapport à ceux de trois ou quatre.
En 1885, le chimiste allemand Adolf von Baeyer a proposé que l'instabilité des petits cycles était due à la tension des angles de liaison. Les carbones sp 3 ont des angles de liaison naturels de 109,5º, dans le cyclopropane ces angles sont de 60º, soit un écart de 49,5º. Cette déviation se traduit par un stress, qui provoque une instabilité dans la molécule.
Le cyclobutane est plus stable car ses angles de liaison sont de 90º et la déviation n'est que de 19,5º. Baeyer a appliqué ce raisonnement aux autres cycloalcanes et a prédit que le cyclopentane devrait être plus stable que le cyclohexane.
contrainte angulaire
Observez les angles de liaison des différents cycloalcanes :
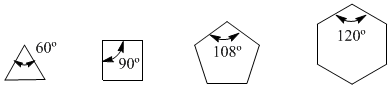
Puisque l'angle naturel d'un carbone sp 3 est de 109,5º, von Baeyer a estimé que le cycloalcane le plus stable était le cyclopentane. Cependant, nous savons que Baeyer avait tort puisque le cycloalcane le plus énergétique (le plus stable) est le cyclohexane. L'erreur de Bayer est de supposer que les cycloalcanes sont plans et que le seul type de déformation qu'ils présentent est dû aux angles de liaison.
Types de tension annulaire
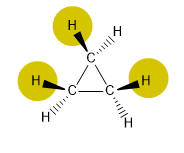
Il existe trois types de stress qui déstabilisent les composés cycliques :
1.- Tension d'angle de liaison, due à des angles différents de 109,5º.
2.- Tension d'éclipse, due aux atomes ou groupes d'atomes proches, qui subissent des répulsions (tension stérique).
Le cyclopropane présente une tension très importante, due aux faibles angles de liaison et aux interactions entre les hydrogènes (éclipsations).