Les halogénures d'hydrogène s'ajoutent aux alcènes, formant des haloalcanes. Le proton agit comme un électrophile, étant attaqué par l'alcène dans la première étape. HF, HCl, HBr, HI peuvent être utilisés comme réactifs dans cette réaction.
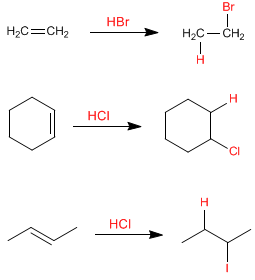
Dans ces exemples, l'alcène est symétrique et peu importe à quel carbone de l'alcène l'hydrogène se lie. Dans les alcènes asymétriques, deux types de produits peuvent être donnés en fonction du carbone sp 2 auquel l'hydrogène est ajouté. Voyons un exemple :
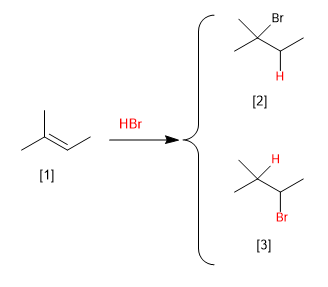
[1] 2-méthyl-2-butène
[2] 2-Bromo-2-méthylbutane
[3] 2-bromo-3-méthylbutane (non formé)
L'addition de HBr au 2-méthyl-2-butène peut générer deux produits, selon que l'hydrogène est ajouté au carbone du méthyle ou à celui voisin. Expérimentalement, on observe que le 2-bromo-2-méthylbutane est obtenu et que le 2-bromo-3-méthylbutane n'apparaît pas comme produit de la réaction.
Comment expliquer ce fait expérimental ? La réponse réside dans le mécanisme de réaction, que nous préciserons ci-dessous.
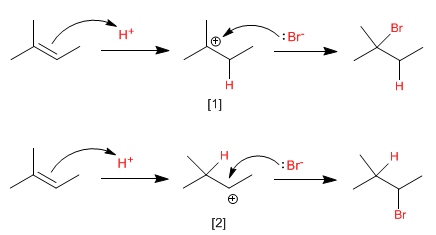
L'étape limitante de ce mécanisme est l'attaque électrophile du proton (première étape), dans cette étape se forme un intermédiaire réactionnel très instable, appelé carbocation.
La plus grande stabilité du carbocation [1] (tertiaire), par rapport à celle du carbocation [2] (secondaire), rend le premier mécanisme plus favorable que le second.