En 1929, le professeur S. Kharasch de l'Université de Chicago a observé l'addition anti-Markovnikov de HBr à un alcène due à la présence de peroxydes dans le milieu réactionnel.

Le brome est ajouté au carbone le moins substitué de l'alcène, tandis que l'hydrogène est attaché au carbone avec plus de substituants (antiMarkovnikov)
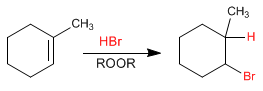
En l'absence de peroxydes, l'addition de HBr à l'alcène est Markovnikov, c'est-à-dire que le brome s'ajoute au carbone le plus substitué.
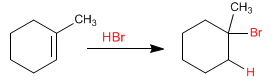
L'addition de bromure d'hydrogène à un alcène suit deux mécanismes différents selon la présence ou l'absence de peroxydes dans le milieu réactionnel.
En l'absence de peroxydes, un carbocation se forme à la position la plus substituée de l'alcène.
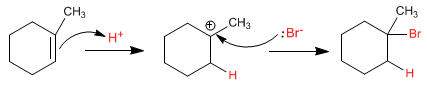
En présence de peroxydes, un mécanisme radicalaire est suivi, avec formation d'un intermédiaire de type radicalaire sur le carbone le plus substitué de l'alcène.
Voyons le mécanisme de la réaction globale suivante :
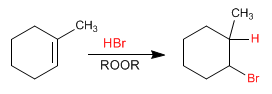
a) initiation
L'initiation se déroule en deux étapes :
Étape 1. Le peroxyde se dissocie en deux radicaux alcoxy.
Étape 1. Le peroxyde se dissocie en deux radicaux alcoxy.
Étape 2. Extraction de l'hydrogène du bromure d'hydrogène par le radical alcoxy, formant des radicaux brome qui passent à l'étape de propagation.
b) Propagation
La propagation comprend deux étapes :
Étape 3. Le radical bromo est ajouté à l'alcène.
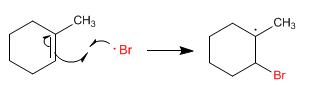
Étape 4. Le radical formé sur le carbone extrait l'hydrogène du bromure d'hydrogène, formant de nouveaux radicaux de brome.
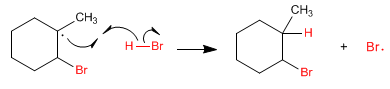
Cette addition est anti-Markovnikov puisque le radical formé à l'étape 3 est tertiaire (fortement stabilisé par hyperconjugaison). Une addition de Markovnikov générerait un radical secondaire beaucoup plus instable.