Les amines ont des points de fusion et d'ébullition plus bas que les alcools. Ainsi, l'éthylamine bout à 17 ºC, tandis que le point d'ébullition de l'éthanol est de 78 ºC.
CH 3 CH 2 OH P.b. = 78ºC
CH 3 CH 2 NH 2 P. eb. = 17ºC
L'électronégativité plus faible de l'azote, comparée à celle de l'oxygène, rend les liaisons hydrogène formées par les amines plus faibles que celles formées par les alcools.
On observe également que les amines primaires ont des points d'ébullition plus élevés que les secondaires et ceux-ci à leur tour plus élevés que les tertiaires.
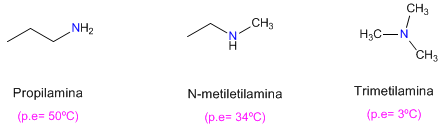
L'amine tertiaire ne peut pas former de liaisons hydrogène (elle manque d'hydrogène sur l'azote), ce qui explique son bas point d'ébullition.
Dans le cas de l'amine secondaire, les encombrements stériques dus aux chaînes entourant l'azote gênent les interactions entre molécules.
Les amines à moins de sept atomes de carbone sont solubles dans l'eau.