THÉORIE DES ALCANES
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 2078
Que sont les alcanes ?
Les alcanes sont des composés formés exclusivement de carbone et d'hydrogène (hydrocarbures), qui ne contiennent que de simples liaisons carbone-carbone.
Types d'alcanes
Les alcanes sont classés en linéaires, ramifiés, cycliques et polycycliques.
Nomenclature des alcanes
Les alcanes sont nommés en terminant par -ane le préfixe qui indique le nombre de carbones dans la molécule (méthane, éthane, propane...)
Propriétés physiques des alcanes
Les points de fusion et d'ébullition des alcanes sont bas et augmentent à mesure que le nombre de carbones augmente en raison des interactions entre les molécules par les forces de Londres. Les alcanes linéaires ont des points d'ébullition plus élevés que leurs isomères ramifiés.
Isomères conformationnels
Les alcanes ne sont pas rigides en raison du spin autour de la liaison CC. Les formes multiples créées par ces rotations sont appelées conformations.
Projection de Newman
L'énergie des différentes conformations peut être vue dans les projections de Newman. Ainsi, dans le cas de l'éthane, la conformation éclipsée est celle dont l'énergie est la plus élevée, en raison des répulsions entre les hydrogènes.
Diagrammes d'énergie potentielle
Les différentes conformations des alcanes peuvent être représentées dans un diagramme d'énergie potentielle, où l'on peut voir quelle conformation est la plus stable (énergie minimale) et l'énergie nécessaire pour passer d'une conformation à une autre.
Combustion des alcanes
Compte tenu de leur faible réactivité, les alcanes sont aussi appelés paraffines. Les réactions les plus importantes de ce groupe de composés sont les halogénations radicalaires et la combustion. La combustion est la combinaison d'hydrocarbure avec de l'oxygène pour former du dioxyde de carbone et de l'eau.
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 242067
Les hydrocarbures sont des composés qui ne contiennent que du carbone et de l'hydrogène. Ils sont divisés en deux classes : les hydrocarbures aliphatiques et aromatiques.
Les hydrocarbures aliphatiques comprennent trois classes de composés : les alcanes, les alcènes et les alcynes. Les alcanes sont des hydrocarbures qui ne contiennent que des liaisons simples carbone-carbone, les alcènes contiennent des doubles liaisons carbone-carbone et les alcynes sont des hydrocarbures qui contiennent une triple liaison. 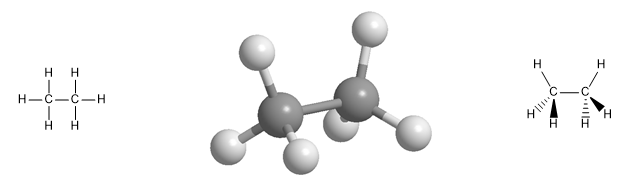
Modèle moléculaire de la molécule d'éthane. L'éthane a une géométrie tétraédrique, avec du carbone au centre du tétraèdre et des hydrogènes orientés vers ses sommets. Notez la représentation spatiale avec des coins et des lignes pointillées .
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 180795
Les alcanes sont des composés composés de carbone et d'hydrogène qui ne contiennent que des liaisons simples carbone-carbone. Ils répondent à la formule générale CnH2n+2 , où n est le nombre de carbones dans la molécule.
Les alcanes dans lesquels les carbones sont liés de manière continue (sans ramifications) sont appelés alcanes à chaîne droite .
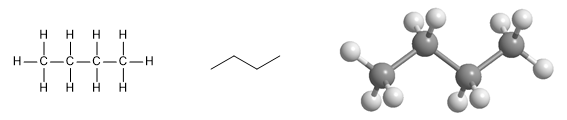
Molécule de butane. Le premier dessin montre la forme d'union des atomes, dans le second la forme en zig-zag de la molécule et enfin son modèle moléculaire, où l'on observe la disposition spatiale des atomes.
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 366541
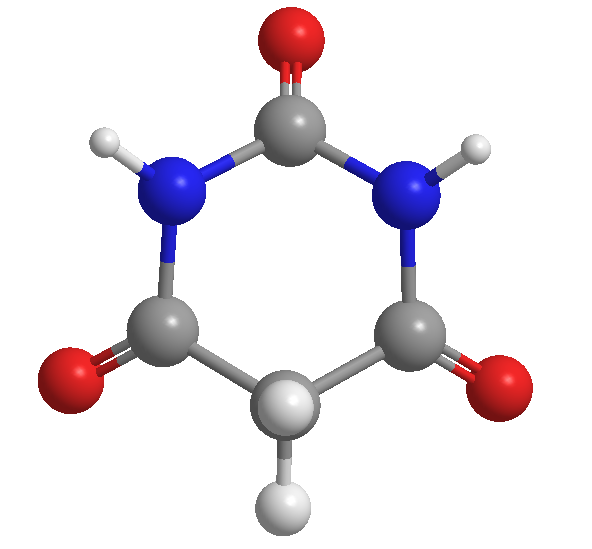
Acide barbiturique, découvert par Adolf von Baeyer, en 1864
Aux origines de la chimie, les composés organiques étaient nommés par leurs découvreurs. L'urée tire son nom du fait qu'elle est isolée de l'urine.
L'acide barbiturique a été découvert par le chimiste allemand Adolf von Baeyer en 1864. On suppose qu'il lui a donné ce nom en l'honneur d'une amie nommée Barbara.
La science chimique progresse et le grand nombre de composés organiques découverts rend indispensable l'utilisation d'une nomenclature systématique.

[1] isobutane (nom commun) ; méthylpropane (nom IUPAC)
[2] isopentane (nom commun) ; méthylbutane (nom IUPAC)
Dans le système de nomenclature IUPAC, un nom est composé de trois parties : préfixes, principaux et suffixes ; Les préfixes indiquent les substituants de la molécule ; le suffixe indique le groupe fonctionnel de la molécule ; et la partie principale le nombre de carbones dont il dispose.
Les alcanes peuvent être nommés en sept étapes :
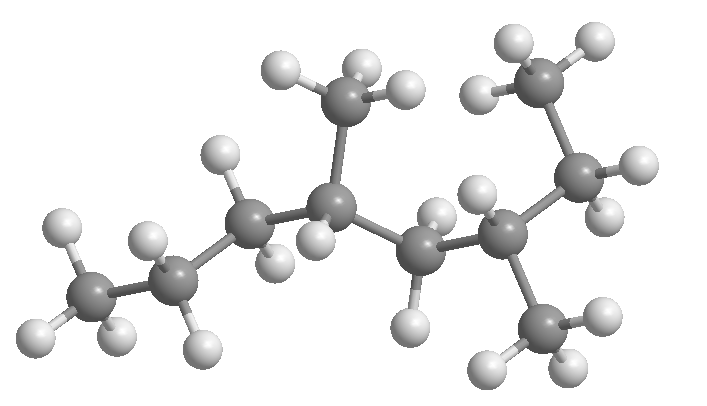
Règle 1.- Déterminer le nombre de carbones de la chaîne la plus longue, appelée chaîne principale de l'alcane. Observez sur les figures qu'il ne s'agit pas toujours de la chaîne horizontale.
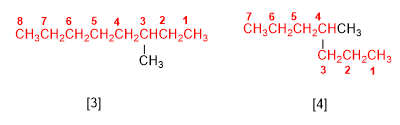
[3] 3-méthyloctane
[4] 4-méthylheptane
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 65113
Règle 1. Le nom d'un composé bicyclique est construit avec le mot Bicyclo, suivi d'une parenthèse indiquant le nombre de carbones dans chacune des trois chaînes qui partent des carbones têtes de pont. Le nom se termine par celui de l'alcane avec le même nombre de carbones.

[1] Bicyclo[2.2.1]heptane
[2] Bicyclo[3.2.1]octane
[xxx] Les carbones en tête de pont du composé bicyclique sont dessinés avec un point bleu. Le nombre de carbones de chacune de ces chaînes (numérotés en rouge) est indiqué entre parenthèses, sans compter les carbones têtes de pont. Notez que les nombres sont classés du plus élevé au plus bas et sont séparés par des points (pas des virgules).
Le nom du composé bicyclique se termine par celui de l'alcane ayant le même nombre de carbones.
Lire la suite : Nomenclature des composés bicycliques - Règles IUPAC
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 197041
Le méthane (CH4), l'éthane (C2H6 ) et le propane (C3H8) sont des alcanes avec une seule structure possible. Cependant, il existe deux alcanes de formule C4H10 ; butane et 2-méthylpropane. Ces alcanes de même formule mais de structures différentes sont appelés isomères.

[1] Butane
[2] 2-Méthylpropane
Le n-butane et l'isobutane ont la même formule mais diffèrent par la façon dont leurs atomes sont liés - ce sont des isomères structuraux -. Leur structure différente leur confère des propriétés différentes, ainsi, ils diffèrent d'environ 20 ºC dans leur point de fusion et d'environ 10 ºC dans leur point d'ébullition.
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 276206
Les alcanes sont des composés hybrides sp3 sur tous les carbones. Les quatre substituants qui partent de chaque carbone sont disposés vers les sommets d'un tétraèdre.
Les distances et les angles de liaison sont indiqués sur les modèles suivants. 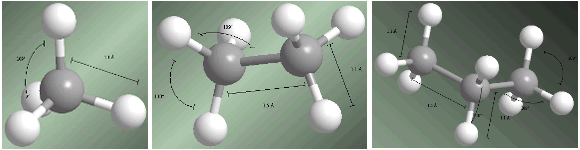
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 148665
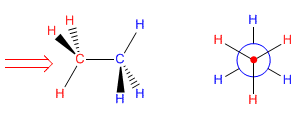 La projection de Newman est obtenue en regardant la molécule le long de l'axe CC. Le carbone avant est représenté par un point, à partir duquel partent les trois liaisons qui le relient aux substituants. Le carbone derrière est représenté par un cercle, et les liaisons quittant ce carbone sont tirées de ce cercle.
La projection de Newman est obtenue en regardant la molécule le long de l'axe CC. Le carbone avant est représenté par un point, à partir duquel partent les trois liaisons qui le relient aux substituants. Le carbone derrière est représenté par un cercle, et les liaisons quittant ce carbone sont tirées de ce cercle.
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 117161
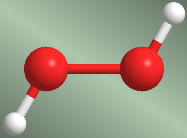 Les liaisons simples entre les atomes ont une symétrie cylindrique et permettent la rotation des groupes d'atomes qui leur sont attachés. Les différentes dispositions spatiales que les atomes adoptent à la suite de la rotation autour de la liaison sont appelées conformations. Une conformation particulière parmi de nombreuses possibles est appelée un conformateur.
Les liaisons simples entre les atomes ont une symétrie cylindrique et permettent la rotation des groupes d'atomes qui leur sont attachés. Les différentes dispositions spatiales que les atomes adoptent à la suite de la rotation autour de la liaison sont appelées conformations. Une conformation particulière parmi de nombreuses possibles est appelée un conformateur.
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 115673
L'éthane est l'alcane le plus simple qui puisse exister sous différentes conformations. Parmi les conformations infinies qui peuvent être obtenues en tournant la liaison carbone-carbone, les conformations alternées et éclipsées se distinguent par leur importance.
- Détails
- Germán Fernández
- THÉORIE DES ALCANES
- Affichages : 90363
Considérons la liaison C2-C3 du butane. Les virages à 60º autour de ce lien vont générer les éventuelles conformations du butane. Il existe trois conformations d'une importance particulière appelées; butane syn , butane anti et butane gauche que nous représentons dans les modèles suivants.
La conformation « anti » du butane est celle dont l'énergie est la plus faible. Les méthyles sont sur les côtés opposés, minimisant les répulsions. 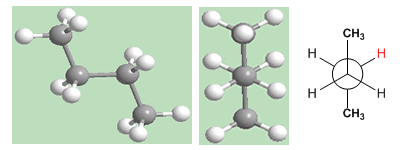
Dans la conformation gauche, la proximité des méthyles donne lieu à une interaction répulsive, appelée interaction gauche. Cette répulsion entre les méthyles est d'environ 3,2 Kcal/mol.