THÉORIE DES ENOLS ET ENOLATES
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 39593
Les aldéhydes et les cétones ont des hydrogènes acides dans la position voisine du groupe carbonyle, connue sous le nom de position alpha. Ces hydrogènes ont un pKa compris entre 18 et 21. 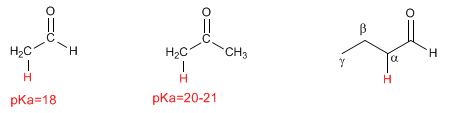
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 32389
Les énolates agissent comme nucléophiles par le carbone, attaquant un grand nombre d'électrophiles (haloalcanes, époxydes, carbonyles, esters...). À ce stade, nous nous concentrerons sur la réaction entre les enlolates et les haloalcanes, qui permet l'ajout de chaînes carbonées en position a de la chaîne.
La cyclohexanone est convertie en 2-méthylcyclohexanone par traitement avec du LDA suivi d'iodure de méthyle. 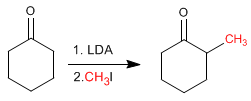
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 21436
Les aldéhydes et les cétones échangent leurs hydrogènes contre des deutériums lorsqu'ils sont traités avec DO - /D 2 O ou avec D + /D 2 O. En milieu basique, la réaction passe par des énolates et en milieu acide, les intermédiaires formés sont des énols. 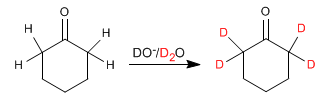
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 56547
Les aldéhydes et les cétones réagissent avec les halogènes en milieu acide ou basique, produisant la substitution des hydrogènes aux halogènes.
Halogénation de la propanone en milieu acide : 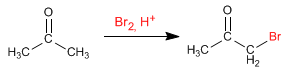
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 107483
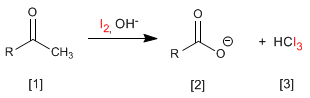
Les méthylcétones [1] réagissent avec les halogènes dans des milieux basiques générant des carboxylates [2] et des haloformes [ 3] .
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 116053
Les aldéhydes et les cétones se condensent dans les milieux basiques pour former des aldols. Cette réaction est appelée condensation d'aldol. 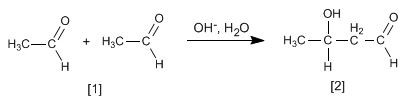
L'aldol formé se déshydrate en milieu basique par chauffage pour former un a , b -insaturé. 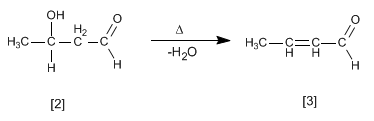
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 51034
Les cétones sont moins réactives que les aldéhydes et donnent un très faible rendement en condensation aldolique. Ainsi, deux molécules de propanone se condensent pour former l'aldol correspondant avec un rendement de 2 %. Des pourcentages élevés du produit peuvent être obtenus en le séparant du milieu réactionnel au fur et à mesure de sa formation, ou en le chauffant pour le déshydrater. Dans les deux cas, les équilibres aldol se déplacent vers le produit final. 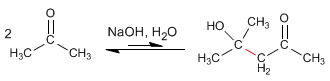
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 45240
Les composés dicarbonyles se condensent via l'aldol intramoléculaire dans les milieux basiques. Dans cette réaction, des cycles de cinq ou six membres sont obtenus.
Ainsi, la 2,6-heptanedione se condense avec le méthylate dans le méthanol pour former la 3-méthylcyclohex-2-énone. 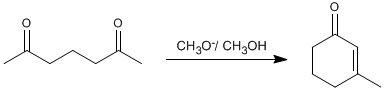
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 78391
La réaction entre deux carbonyles différents est appelée aldol croisé ou mixte. Cette réaction n'a d'utilité synthétique que dans deux cas :
1. Un seul des carbonyles peut former des énolates.
2. L'un des carbonyles est beaucoup plus réactif que l'autre.
Dans toutes les autres situations, l'aldol mixte génère des mélanges de quatre produits. Voyons par exemple la condensation de l'éthanal et du propanal. 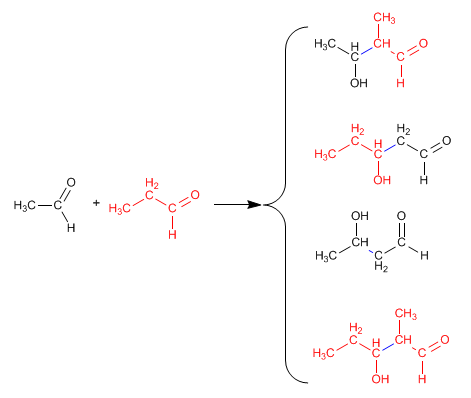
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 67753
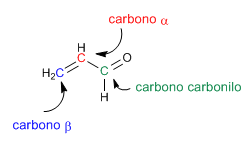 Les carbonyles a,b -insaturés sont des composés organiques qui ont une double liaison entre les positions a,b d'un aldéhyde ou d'une cétone.
Les carbonyles a,b -insaturés sont des composés organiques qui ont une double liaison entre les positions a,b d'un aldéhyde ou d'une cétone.
Le propénal ou acroléine est un carbonyle a,b -insaturé. Ses deux doubles liaisons conjuguées lui confèrent une réactivité particulière.
Lire la suite : Synthèse de carbonyles alpha, bêta-insaturés
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 51357
Les a,b -insaturés sont des composés qui ont deux positions électrophiles : le carbone carbonyle et le carbone b .
Ajouts 1,2. Les organométalliques du lithium attaquent le carbone carbonyle en donnant lieu à des additions en 1,2.
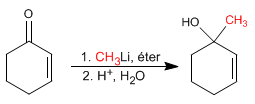
{nota} Les organométalliques du lithium et du magnésium attaquent le carbone carbonylé des a,b -insaturés{/nota}
Lire la suite : Réactivité des carbonyles alpha, bêta-insaturés
- Détails
- Germán Fernández
- THÉORIE DES ENOLS ET ENOLATES
- Affichages : 55131
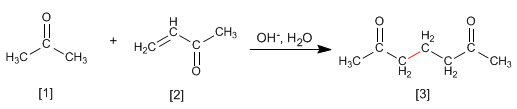
La propanone réagit avec a,b -insaturé pour former du 1,5-dicarbonyle