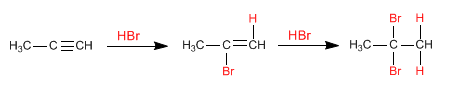
Semblables aux alcènes, les alcynes ajoutent des halogénures d'hydrogène (HBr, HCl, HI) à la triple liaison pour former des halogénures d'alcényle.
Le mécanisme de réaction se produit par l'intermédiaire d'un carbocation, formé sur le carbone le plus substitué de la triple liaison. Il s'agit donc d'une réaction régiosélective qui suit la règle de Markovnikov, en ajoutant l'halogène au carbone le plus substitué de l'alcyne.
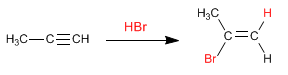
Étape 1. Addition électrophile. Le proton s'ajoute à la triple liaison, joignant le carbone le moins substitué.
Etape 2. L'halogène capte le carbocation formé à l'étape précédente.
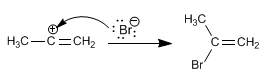
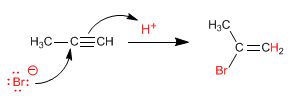
Compte tenu de la grande instabilité du carbocation formé (cation alcényle) le mécanisme précédent est remis en cause. Un autre mécanisme alternatif est celui concerté (une seule étape, sans formation d'intermédiaires).
En présence de deux équivalents de l'halogénure d'hydrogène, des ajouts successifs à l'alcyne se produisent, formant des dihaloalcanes géminés.