Le borohydrure de sodium $(NaBH_4)$ et l'hydrure de lithium aluminium $(LiAlH_4)$ réduisent les aldéhydes et les cétones en alcools.
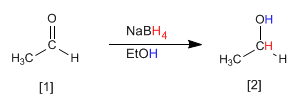
L'éthanal [1] est transformé par réduction au borohydrure de sodium en éthanol [2].
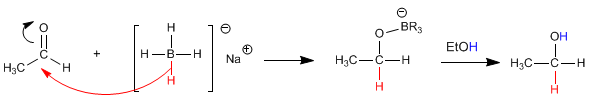
Le mécanisme se produit par attaque de l'hydrure du réducteur sur le carbone carbonyle. Dans un deuxième temps, le solvant protone l'oxygène de l'alcoolate.
L'hydrure de lithium et d'aluminium agit en milieu éthéré et transforme les aldéhydes et les cétones en alcools après une étape d'hydrolyse acide.
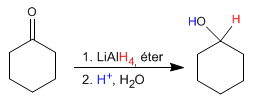
Le mécanisme est analogue à celui du borohydrure de sodium.
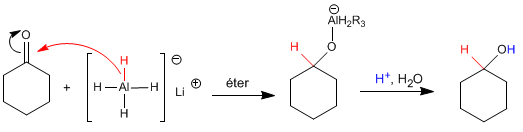
Le réducteur lithium et aluminium est plus réactif que celui au bore, il réagit avec l'eau et les alcools en libérant de l'hydrogène. Par conséquent, il doit être dissous dans un milieu aprotique (éther).
Le réducteur de bore moins réactif se décompose lentement en milieu protique, ce qui lui permet d'être utilisé dissous dans de l'éthanol ou de l'eau.