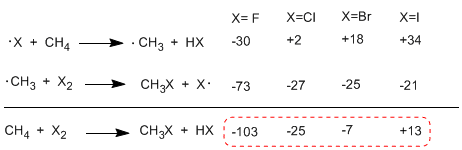THÉORIE DES RÉACTIONS D'HALOGÉNATION
- Détails
- Germán Fernández
- THÉORIE DES RÉACTIONS D'HALOGÉNATION
- Affichages : 1706
Les alcanes réagissent avec les halogènes par des mécanismes radicalaires. Cette réaction suppose la substitution d'un ou plusieurs hydrogènes de l'alcane par des halogènes.
Mécanisme d'halogénation radicalaire
Le mécanisme d'halogénation radicalaire comprend trois étapes : initiation, propagation et terminaison. Lors de l'initiation, la molécule d'halogène se rompt de manière homolytique, générant des radicaux. Dans l'étape de propagation, la substitution des hydrogènes de l'alcane par des halogènes se produit. Lorsque les réactifs sont épuisés, les radicaux du milieu s'unissent les uns aux autres, produisant l'étape de terminaison.
Réactivité halogène
La première étape de propagation détermine la vitesse de la réaction. Pour le fluor, cette étape a une faible énergie d'activation, ce qui fait du fluor l'halogène le plus réactif. Dans le cas de l'iode, l'énergie d'activation est très élevée et la réaction n'a pas lieu. Ordre de réactivité dans les réactions radicalaires : $F_2>Cl_2>Br_2>I_2$. En bref, l'iode ne réagit pas à l'halogénation radicalaire et le fluor réagit violemment.
polyhalogénations
La réaction d'halogénation est difficile à arrêter car le produit halogéné est plus réactif que l'alcane de départ. Pour éviter ce problème, appelé polyhalogénations, un excès d'alcane est utilisé.
stabilité radicale
Le mécanisme de ces réactions se produit avec la formation d'un intermédiaire appelé radical dont la stabilité dépend du nombre de substituants qui entourent le carbone contenant l'électron solitaire. Les radicaux formés lors de l'étape de propagation sont stabilisés par hyperconjugaison. L'ordre de stabilité des radicaux est donné par : tertiaire> secondaire> primaire.
- Détails
- Germán Fernández
- THÉORIE DES RÉACTIONS D'HALOGÉNATION
- Affichages : 50744
MÉCANISME DE RÉACTION
Les halogénations radicalaires se déroulent en trois étapes appelées : initiation, propagation et terminaison :
phase d'initiation
Dans la première étape de la réaction, le clivage homolytique de la liaison Cl-Cl se produit. Ceci est réalisé avec de la chaleur ou en absorbant la lumière.
![]()
- Détails
- Germán Fernández
- THÉORIE DES RÉACTIONS D'HALOGÉNATION
- Affichages : 25714
Nous allons représenter dans un diagramme d'énergie les deux étapes de propagation de l'halogénation du méthane.
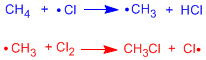
La première étape de propagation est celle qui limite la vitesse du processus, elle possède l'énergie d'activation la plus élevée. Le diagramme représente les réactifs, les produits, les intermédiaires et les états de transition pour l'halogénation radicalaire du méthane.
- Détails
- Germán Fernández
- THÉORIE DES RÉACTIONS D'HALOGÉNATION
- Affichages : 21590
En comparant les enthalpies des étapes de propagation des différents halogènes, des différences importantes dans les chaleurs échangées sont observées. Dans le cas du fluor, les deux étapes sont exothermiques (même le prélèvement d'hydrogène) avec un bilan énergétique global de -103 Kcal/mol. Les énergies d'activation des états de transition dans cette réaction sont très faibles, ce qui en fait l'halogène le plus réactif.
À l'autre extrême de la réactivité se trouve l'iode, dont la réaction est endothermique et n'a pas lieu.
Ordre de réactivité F 2>Cl 2> Br 2> I 2
Le tableau suivant montre la chaleur échangée dans les étapes de propagation pour l'halogénation du méthane.
La réaction est fortement exothermique dans le cas du fluor (halogène plus réactif) alors que dans le cas de l'iode elle est endothermique à 13 Kcal/mol.
- Détails
- Germán Fernández
- THÉORIE DES RÉACTIONS D'HALOGÉNATION
- Affichages : 21943
La rupture homolytique de la liaison CH d'un alcane produit des radicaux alkyles et des atomes d'hydrogène libres. L'énergie nécessaire pour que cette cassure se produise est appelée énergie de dissociation et elle est d'autant plus faible que le radical formé est stable.
Comme on peut le voir à partir des réactions suivantes, l'énergie nécessaire pour rompre une liaison CH primaire est beaucoup plus élevée que celle nécessaire pour rompre une liaison CH tertiaire.
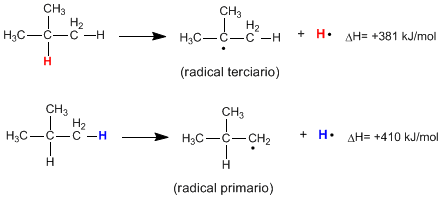
Lire la suite : Stabilité radicalaire dans les halogénations radicalaires
- Détails
- Germán Fernández
- THÉORIE DES RÉACTIONS D'HALOGÉNATION
- Affichages : 26245
Dans le propane, il existe deux types d'hydrogènes non équivalents qui peuvent être remplacés par des halogènes, obtenant le 1-chloropropane et le 2-chloropropane.
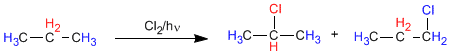
La proportion dans laquelle ces produits sont obtenus dépend de deux facteurs : le nombre d'hydrogènes à remplacer par de l'halogène et la stabilité du radical formé.
Lire la suite : Distribution de produits dans les halogénations