L'eau est un acide très faible, avec une concentration en protons insuffisante pour démarrer la réaction d'addition électrophile. Il est nécessaire d'ajouter un acide (H 2 SO 4 ) au milieu pour que la réaction ait lieu.
Cette réaction est également connue sous le nom d'hydratation des alcènes et génère des alcools.
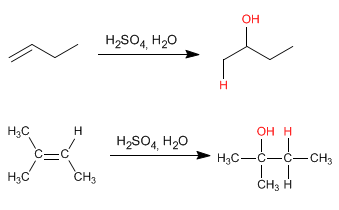
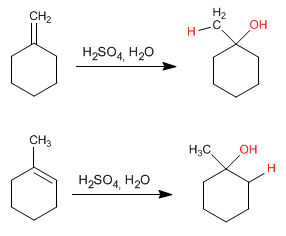
Cette réaction s'effectue avec de l'acide sulfurique dilué 50% sulfurique/H 2 O et ne nécessite pas d'hydrolyse finale.
Le mécanisme se produit avec la formation d'un carbocation après l'ajout du proton à la double liaison. L'hydratation des alcènes est Markovnikov, c'est-à-dire que le proton s'ajoute au carbone le moins substitué de l'alcène (carbone avec plus d'hydrogènes).
Étape 1. Attaque de l'alcène sur le proton (addition électrophile)
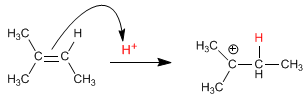
Étape 2. Attaque nucléophile de l'eau sur le carbocation formé
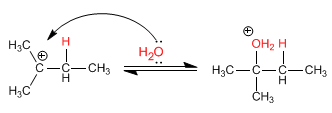
Étape 3. Déprotonation de l'alcool. L'eau sert de base.
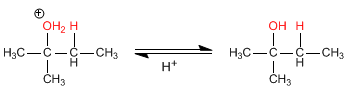
Selon le principe de Le Châtelier, lorsque la concentration d'un réactif augmente, l'équilibre se déplace vers le produit final. Pour augmenter le rendement de cette réaction, un excès d'eau peut être ajouté, provoquant un déplacement de l'équilibre vers l'alcool final.
L'hydratation des alcènes est une réaction de Markovnikov.