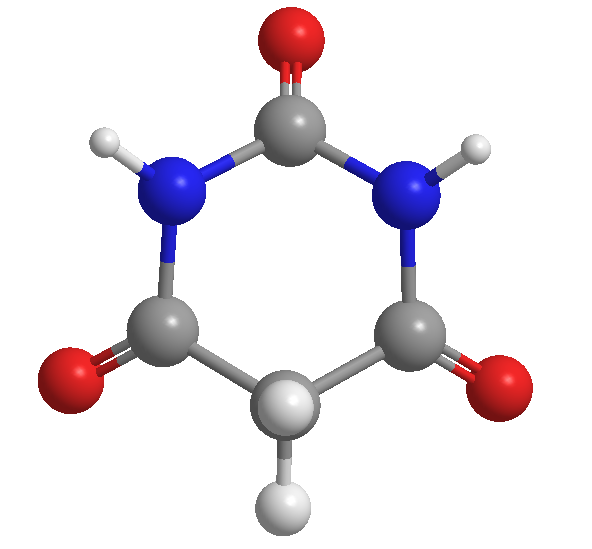
Acide barbiturique, découvert par Adolf von Baeyer, en 1864
Aux origines de la chimie, les composés organiques étaient nommés par leurs découvreurs. L'urée tire son nom du fait qu'elle est isolée de l'urine.
L'acide barbiturique a été découvert par le chimiste allemand Adolf von Baeyer en 1864. On suppose qu'il lui a donné ce nom en l'honneur d'une amie nommée Barbara.
La science chimique progresse et le grand nombre de composés organiques découverts rend indispensable l'utilisation d'une nomenclature systématique.

[1] isobutane (nom commun) ; méthylpropane (nom IUPAC)
[2] isopentane (nom commun) ; méthylbutane (nom IUPAC)
Dans le système de nomenclature IUPAC, un nom est composé de trois parties : préfixes, principaux et suffixes ; Les préfixes indiquent les substituants de la molécule ; le suffixe indique le groupe fonctionnel de la molécule ; et la partie principale le nombre de carbones dont il dispose.
Les alcanes peuvent être nommés en sept étapes :
Règle 1.- Déterminer le nombre de carbones de la chaîne la plus longue, appelée chaîne principale de l'alcane. Observez sur les figures qu'il ne s'agit pas toujours de la chaîne horizontale.
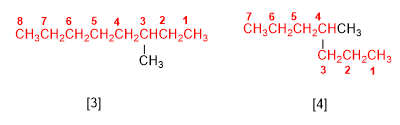
[3] 3-méthyloctane
[4] 4-méthylheptane
Le nom de l'alcane se termine par le nom de la chaîne principale (octane, heptane) et est précédé des substituants.
Règle 2.- Les substituants sont nommés en changeant la terminaison -ane de l'alcane dont ils dérivent par -yl (méthyle, éthyle, propyle, butyle). Dans le nom de l'alcane, les substituants précèdent le nom de la chaîne principale et sont accompagnés d'un locant qui indique leur position au sein de la chaîne principale. La numérotation du squelette est effectuée de sorte que le substituant se voit attribuer le locant le plus bas possible. 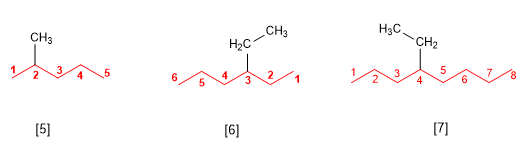
[5] 2-Méthylpentane
[6] 3-éthylhexane
[7] 4-éthyloctane
Règle 3.- Si nous avons plusieurs substituants, ils sont classés par ordre alphabétique précédés des localisateurs. La numérotation de la chaîne principale est faite de manière à ce que les substituants prennent ensemble les locants mineurs.
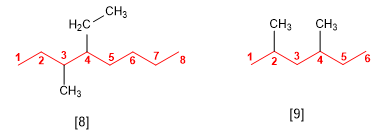
[8] 4-éthyl-3-méthyloctane
[9] 2,4-diméthylhexane
Si plusieurs substituants sont identiques, les préfixes di, tri, tétra, penta, hexa sont utilisés pour indiquer le nombre de fois où chaque substituant apparaît dans la molécule. Les locants sont séparés par des virgules et il doit y en avoir autant que de substituants. 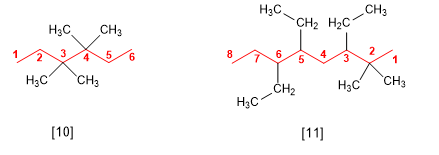
[10] 3,3,4,4-tétraméthylhexane
[11] 3,5,6-Triéthyl-2,2-diméthyloctane
Les préfixes de quantité ne sont pas pris en compte lors du tri alphabétique.
Règle 4.- Si lors de la numérotation de la chaîne principale aux deux extrémités, nous nous trouvons à la même distance avec les premiers substituants, nous regardons les autres substituants et les numérotons de manière à ce qu'ils prennent les locants mineurs. 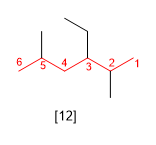
[12] 3-éthyl-2,5-diméthylhexane
Règle 5.- Si par numérotation dans les deux sens on obtient les mêmes locants, le locant le plus bas est attribué au substituant qui vient en premier dans l'ordre alphabétique.
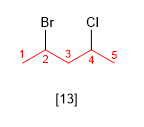
[13] 2-Bromo-4-chloropentane
Règle 6.- Si deux chaînes ou plus ont la même longueur, celle qui a le plus grand nombre de substituants est considérée comme principale. 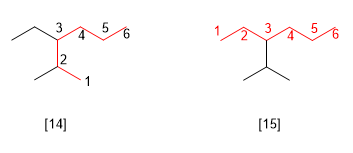
[14] 3-éthyl-2-méthylhexane (correct)
[15 ] 3-isopropylhexane (incorrect)
Règle 7.- Il existe certains substituants avec des noms communs acceptés par l'IUPAC, bien que l'utilisation d'une nomenclature systématique soit recommandée. 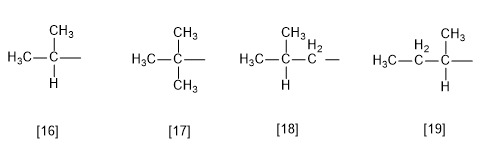
[16 ] Isobutyle (1-méthyléthyle)
[17] tert -butyle (1,1-diméthyléthyle)
[18 ] Isobutyle (2-méthylpropyle)
[19] sec-butyle (1-méthylpropyle)
Les noms systématiques de ces substituants sont obtenus en numérotant la chaîne commençant par le carbone qui rejoint le parent. Le nom du substituant est formé avec le nom de la chaîne la plus longue se terminant par -ilo, précédant les noms des substituants que cette chaîne secondaire possède dans l'ordre alphabétique. Voyons un exemple :
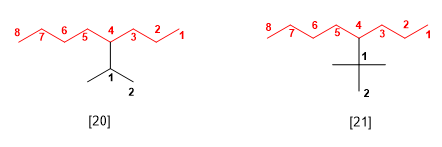
[20] 4-isopropyloctane (4-(1-méthyléthyl)octane)
[21 ] 4-tert-butyloctane (4-(1,1-diméthyléthyl)octane)
Tableau des alcanes ayant moins de 10 atomes de carbone.
Méthane (CH4)
Éthane (CH3CH3)
Propane (CH3CH2CH3)
Butane (CH3CH2CH2CH3)
Pentane (CH3CH2CH2CH2CH3)
Hexane (CH3CH2CH2CH2CH2CH3)
Heptane (CH3CH2CH2CH2CH2CH2CH3)
Octane (CH3CH2CH2CH2CH2CH2CH2CH3)
Nonane (CH3CH2CH2CH2CH2CH2CH2CH2CH3)
Décane (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3)