SOUFRE, PHOSPHORE ET SILICIUM
- Détails
- Germán Fernández
- SOUFRE, PHOSPHORE ET SILICIUM
- Affichages : 2991
Les thiols sont caractérisés par le fait qu'ils contiennent le groupe fonctionnel -SH. Ils sont nommés en terminant le nom de la chaîne principale en -thiol, analogue aux alcools dont la terminaison est -ol
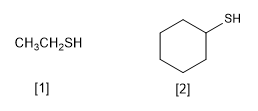
[1] Éthanothiol
[2] Cyclohexanethiol
Les thiols ont une acidité plus élevée que les alcools en raison de la plus grande taille du soufre par rapport à l'oxygène. Les valeurs de pKa se situent autour de 10-11, par rapport aux alcools qui ont des valeurs comprises entre 16 et 18.
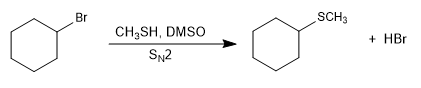
- Détails
- Germán Fernández
- SOUFRE, PHOSPHORE ET SILICIUM
- Affichages : 2846
Ce sont des composés similaires aux éthers dans lesquels l'oxygène est remplacé par du soufre (RSR). Ils sont aussi appelés sulfures.
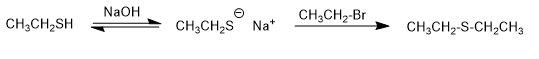
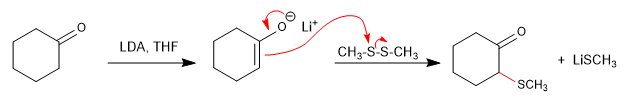
- Détails
- Germán Fernández
- SOUFRE, PHOSPHORE ET SILICIUM
- Affichages : 2217
Les sulfoxydes subissent des réactions d'élimination, sous léger chauffage, pour former des alcènes. Le sulfoxyde peut être facilement préparé par oxydation d'un thioéther, qui est facile à former en position alpha d'un carbonyle à partir d'un disulfure. Cette procédure permet la préparation de carbonyles α,β-insaturés.
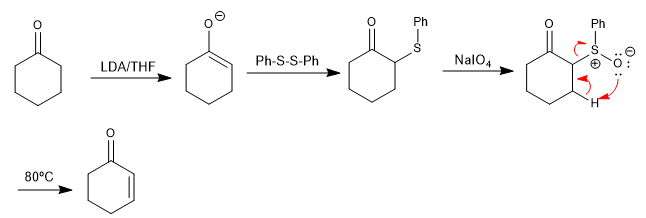
- Détails
- Germán Fernández
- SOUFRE, PHOSPHORE ET SILICIUM
- Affichages : 3501
Les ylures de soufre sont préparés à partir de thioéthers par alkylation, suivie d'une déprotonation.
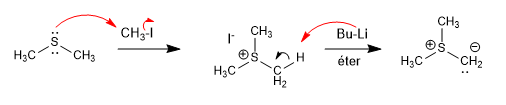
[1] Ylure de soufre
- Détails
- Germán Fernández
- SOUFRE, PHOSPHORE ET SILICIUM
- Affichages : 2896
La réaction des carbonyles avec des thiols forme des thioacétals qui peuvent être utilisés comme groupes protecteurs ou pour réduire le carbonyle en alcane.
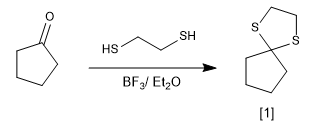
[1] Thioacétal
Le thioacétal est stable en milieu acide mais peut être hydrolysé avec des sels de mercure(II).
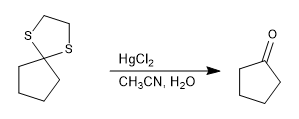
Lire la suite : Thioacétals, hydrolyse et réduction en alcanes
- Détails
- Germán Fernández
- SOUFRE, PHOSPHORE ET SILICIUM
- Affichages : 3192
Les 1,3-dithianes permettent de changer la polarité du carbone carbonyle des aldéhydes par soustraction de l'hydrogène acide, obtenant un organolithique capable d'attaquer une grande variété d'électrophiles.
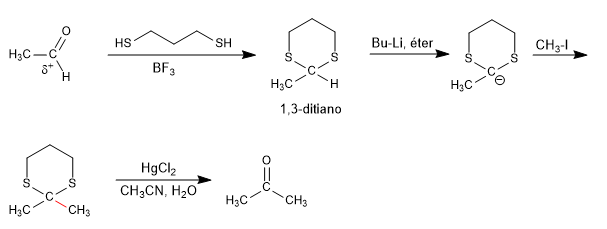
Le carbonyle initial, avec une polarité positive sur le carbone, change dans la réaction umpolung en un carboanion. Les soufres du 1,3-dithiane sont indispensables pour stabiliser la charge négative, et la réaction avec l'équivalent oxygéné n'est pas viable.
Lire la suite : Synthèse de 1,3-dithianes. Réactions UMPOLUNG
- Détails
- Germán Fernández
- SOUFRE, PHOSPHORE ET SILICIUM
- Affichages : 2724
Les phosphines sont obtenues en faisant réagir du trichlorure de phosphore avec des réactifs organométalliques. Ainsi, le trichlorure de phosphore réagit avec le bromure de phénylmagnésium pour former la triphénylphosphine.
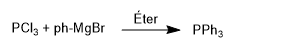
Cette réaction est bien contrôlée et ne permet d'introduire que deux groupements.