Les alcools sont des espèces amphotères (amphiprotiques), ils peuvent agir comme des acides ou des bases. En solution aqueuse, un équilibre s'établit entre l'alcool, l'eau et leurs bases conjuguées.
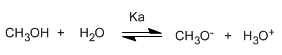
Ecriture de la constante d'équilibre (Ka)
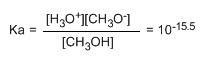
La petite valeur de la constante nous indique que l'équilibre est complètement décalé vers la gauche. Le logarithme modifié de la constante d'équilibre nous donne le pKa du méthanol, un paramètre qui indique le degré d'acidité d'un composé organique.
pKa = - log ka = 15,5
Une augmentation du pKa implique une diminution de l'acidité. Ainsi, le méthanol avec un pka de 15,5 est légèrement plus acide que l'éthanol avec un pka de 15,9.
Le pKa des alcools est influencé par certains facteurs tels que la taille de la chaîne carbonée et les groupes électronégatifs.
À mesure que la longueur de la chaîne carbonée augmente, l'alcool devient moins acide.
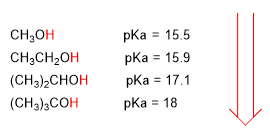
acidité plus faible
Les groupes électronégatifs (halogènes) augmentent l'acidité des alcools (diminuent le pKa)
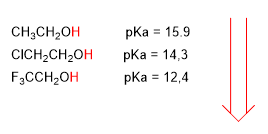
acidité plus élevée