La S N 2 (substitution nucléophile bimoléculaire) est une réaction concertée, c'est-à-dire qu'elle se produit en une seule étape.
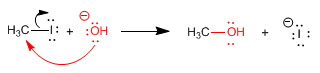
Le mécanisme consiste en ce que le nucléophile attaque le carbone contenant le groupe partant. Ce carbone présente une polarité positive importante, due à l'électronégativité de l'halogène. En même temps que le nucléophile attaque, la liaison carbone-halogène est rompue, obtenant le produit final.
L'état de transition de S N 2 a la forme suivante :
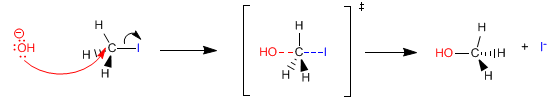
La vitesse d'une réaction élémentaire est proportionnelle au produit des concentrations des réactifs élevés à leurs coefficients stoechiométriques respectifs. La constante de proportionnalité est appelée constante cinétique.
Ainsi, la vitesse de S N 2 dépend de la concentration du substrat (CH 3 I) et du nucléophile (OH - ), et est donc une réaction bimoléculaire.
v=k[CH 3 I][OH - ]