Les alcènes peuvent être préparés à partir d'haloalcanes et d'alkylsulfonates par élimination bimoléculaire (E2). Dans l'exemple suivant, le 2-bromo-2-méthylbutane réagit avec le méthylate de sodium pour former un mélange de 2-méthyl-2-butène et de 2-méthyl-1-butène.
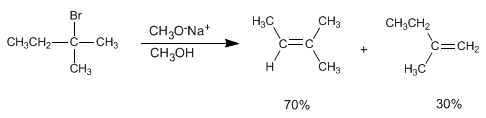
Dans cette élimination, le produit le plus stable (alcène plus substitué) est obtenu, et on dit qu'il suit la règle de Saytzev .
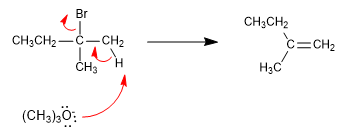
Le méthoxyde, petite base, soustrait l'hydrogène le plus interne de l'haloalcane pour produire le produit le plus stable (alcène thermodynamique).
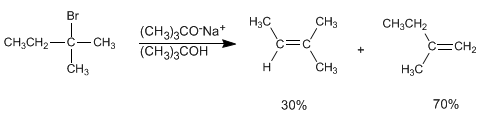
Si nous utilisons le tert-butoxyde ou LDA comme base, l'alcène formé est principalement le 2-méthyl-1-butène. Les bases gênées ont des difficultés à accéder à l'hydrogène le plus interne, soustrayant plus rapidement l'hydrogène le plus accessible, de sorte qu'elles génèrent le produit le moins stable pour la plupart. Dans ce cas, la réaction est contrôlée cinétiquement et suit la règle d'Hofmann .
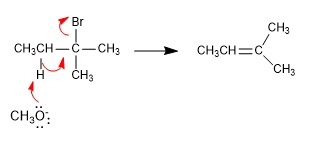
Les hydrogènes situés sur les méthyles sont plus accessibles au tert-butoxyde que les hydrogènes les plus internes. L'alcène formé le plus souvent est le moins substitué (alcène cinétique), et on dit que la réaction suit la règle de Hofmann.