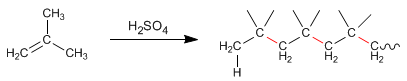RÉACTIONS AUX ALCÈNES
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 116448
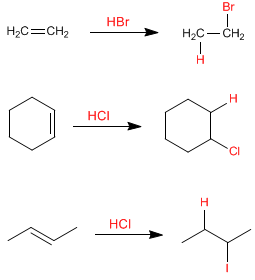
La réaction caractéristique des alcènes est l'addition de substances à la double liaison, selon l'équation : 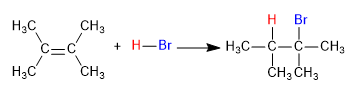
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 134754
L'hydrogénation est l'addition d'hydrogène à une double liaison pour former des alcanes.
Le platine et le palladium sont les catalyseurs les plus couramment utilisés dans l'hydrogénation des alcènes. Le palladium est utilisé sous forme de poudre adsorbée sur du carbone (Pd/C). Le platine est utilisé comme PtO 2 (Adams Catalyst). 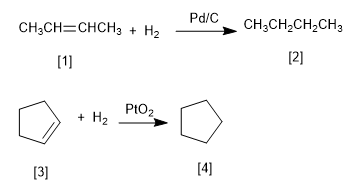
[1] 2-Butène
[2] Butane
[3] Cyclopentène
[4] Cyclopentane
Les alcènes sont hydrogénés des deux côtés, produisant deux énantiomères en proportion égale (mélange racémique).
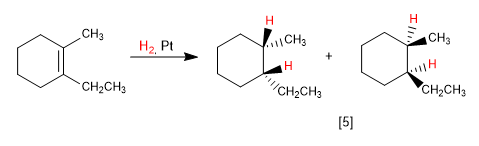
[5 ] Mélange racémique
Lorsque l'alcène a une face plus encombrée que l'autre, on obtient des diastéréoisomères dans des proportions différentes.
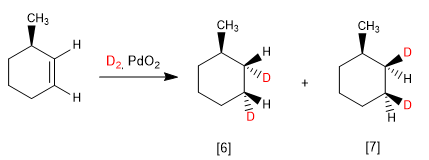
[6 ] Produit majeur de l'hydrogénation. La face inférieure de l'alcène est moins gênée.
[7 ] Produit minoritaire. L'hydrogénation se produit du côté méthyle, ce qui empêche l'approche du réactif
En vélo la face la plus favorable est celle du côté du pont :
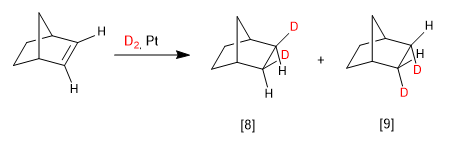
[8 ] Produit principal. Le pont du vélo est la chaîne qui exerce le moins d'entrave.
[9 ] Produit minoritaire.
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 74807
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 102870
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 144020
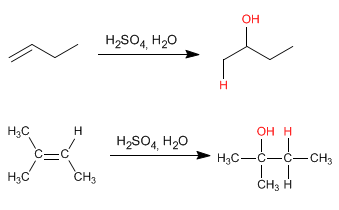
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 92498
Le chlore et le brome s'ajoutent aux alcènes pour donner des 1,2-dihaloalcanes. Par exemple, le 1,2-dichloroéthane est synthétisé en ajoutant du chlore à l'éthène. 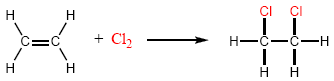
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 71876
Les alcènes réagissent avec les halogènes dans un milieu aqueux pour former des halohydrines, des composés qui contiennent un halogène et un groupe hydroxyle dans des positions voisines.
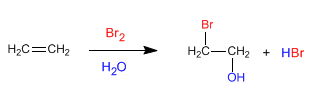
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 60357
Les alcènes peuvent être hydratés avec de l'acétate de mercure aqueux suivi d'une réduction avec du borohydrure de sodium. Cette réaction produit des alcools et suit la règle de Markovnikov.
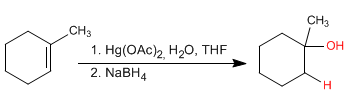
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 79775
L'hydroboration est une réaction dans laquelle un hydrure de bore [2] réagit avec un alcène [1] pour donner un organoborane [3].
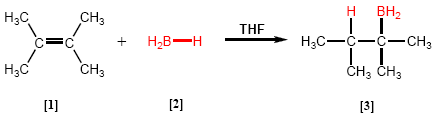
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 64516
La dihydroxylation d'un alcène consiste à ajouter un groupe -OH à chaque carbone pour former des diols vicinaux. Cette réaction peut être effectuée avec du tétroxyde d'osmium dans du peroxyde d'hydrogène, ou avec du permanganate de potassium dans de l'eau.
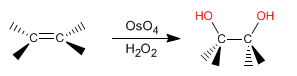
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 86947
Les alcènes réagissent avec les peracides (peroxyacides) pour former des époxydes. Les époxydes sont des cycles à trois chaînons qui contiennent de l'oxygène.
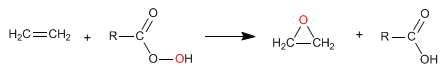
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 135041
Les alcènes réagissent avec l'ozone pour former des aldéhydes, des cétones ou des mélanges des deux après une étape de réduction.
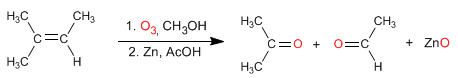
- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 82038
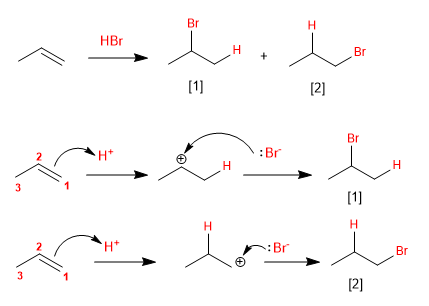
En 1929, le professeur S. Kharasch de l'Université de Chicago a observé l'addition anti-Markovnikov de HBr à un alcène due à la présence de peroxydes dans le milieu réactionnel.

- Détails
- Germán Fernández
- RÉACTIONS AUX ALCÈNES
- Affichages : 94839
Les alcènes, en présence d'acide sulfurique concentré, se condensent pour former des chaînes appelées polymères. Voyons un exemple avec le 2-méthylpropène