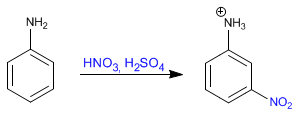
Le groupe amino est un activateur puissant, s'orientant vers ortho/para. Cependant, dans les milieux acides, il est protoné, se transformant en un puissant désactivateur (sel d'ammonium) qui s'oriente vers la position méta.
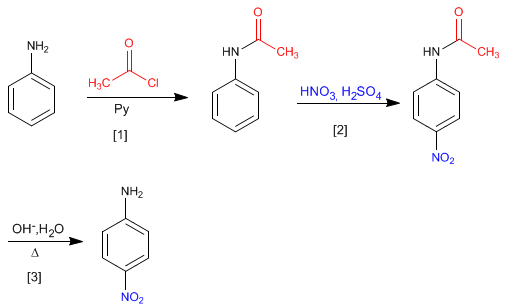
La protonation de l'amino peut être évitée en le protégeant avec du chlorure d'éthanoyle dans de la pyridine.
Nitrate d'aniline sans protection aminée
Nitration de l'aniline avec protection du groupe amino, à l'aide de chlorure d'éthanoyle
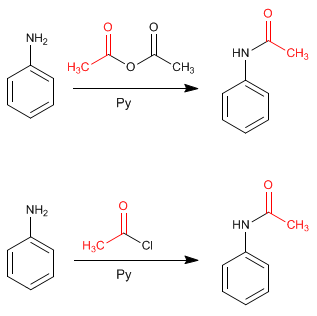
La protection amino peut être effectuée avec de l'anhydride éthanoïque dans de la pyridine ou avec du chlorure d'éthanoyle dans de la pyridine.
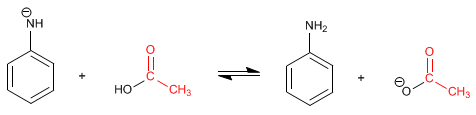
Le produit final est un amide, beaucoup moins basique que l'amine de départ et moins sujet à la protonation. Le mécanisme de la réaction est le suivant :
Étape 1. Ajout
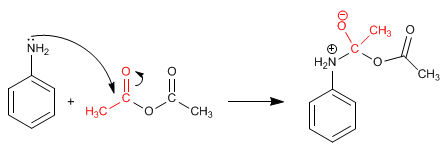
Étape 2. Équilibre acido-basique
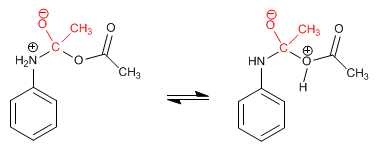
Étape 3. Élimination
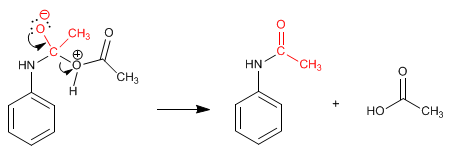
L'amide formé est déprotégé par hydrolyse acide ou basique, laissant l'aniline libre.
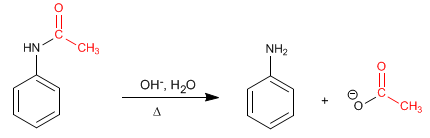
Mécanisme de déprotection en milieu basique.
Étape 1. Ajout du groupe hydroxyle à l'amide
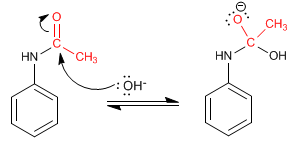
Étape 2. Élimination
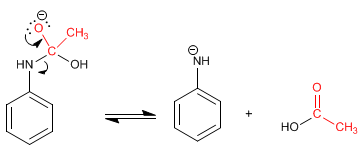
Étape 3. Équilibre acido-basique