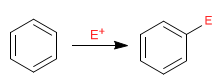
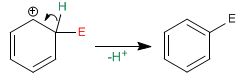Le benzène agit comme un nucléophile, attaquant un nombre important et varié d'électrophiles.
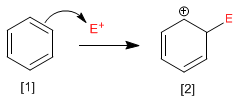
Étape 1. Dans la première étape de la réaction, l'électrophile accepte une paire d'électrons du nuage p de benzène, formant un carbocation stabilisé par résonance.
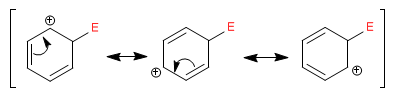
Le cation cyclohexadiényle [2] délocalise la charge positive selon les structures suivantes :
Étape 2. Dans la deuxième étape, le benzène récupère son aromaticité en raison de la perte d'un proton. C'est une étape rapide connue sous le nom de réaromatisation de l'anneau.