Dans cette section nous allons étudier l'influence des contraintes annulaires sur les propriétés des hétérocycles.
A) Contrainte angulaire dans les petits hétérocycles (3 et 4 membres).
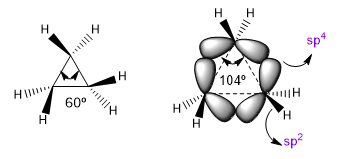
Les angles de liaison naturels d'un carbone sp 3 sont de 109,5o, mais dans les cycles à trois chaînons, cet angle diminue à 60o, ce qui produit une tension énorme. Pour atténuer cette tension, les liaisons entre carbones ne sont plus rectilignes, fléchissantes, donnant naissance à des liaisons courbes appelées « liaisons bananes ». Les angles formés par ces liaisons sont de 104o, un écart plus tolérable.
| Hybridation | angle de liaison |
| sp sp 2 sp 3 sp 4 |
180º 120º 109.5º 104e |
Cette situation fait que les liaisons CC tendent vers une hybridation sp 4 théorique alors que les liaisons CH ont sp 2 . Ces hybridations nous permettront d'expliquer les variations des propriétés spectroscopiques et de basicité. Dans les spectres infrarouges on observe que lorsque le caractère p d'une liaison diminue, l'absorption se déplace vers un plus grand nombre d'ondes. Comparons les amides non cycliques avec les lactames stressés pour voir cet effet.
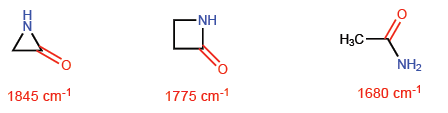
Dans l'azétidine-2-one, le caractère p de la liaison C=O est plus petit que dans les autres molécules et donc l'absorption du rayonnement infrarouge se déplace vers un plus grand nombre d'ondes.
Une autre propriété qui est influencée par la souche de ces hétérocycles est la basicité. Une augmentation du caractère p de la paire isolée produit une diminution de la basicité. Ainsi, entre une amine cyclique et une amine acyclique, le cyclique est moins basique.
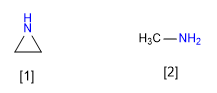
[1] Aziridine
[2] Méthylamine
L'aziridine est moins basique que la méthylamine. L'hybridation par paire isolée de l'aziridine se rapproche de sp2 tandis que celle de la méthylamine est sp3 . Le caractère p plus petit de l'aziridine la rend moins basique.
B) Contrainte annulaire dans les grands anneaux. La cyclooctine est connue pour être le plus petit alcyne cyclique existant. Les plus petits cycloalcynes produisent une distorsion de l'angle de liaison correspondant à l'hybridation sp, générant une tension dans la molécule qui la rend irréalisable.
Cependant, il existe une exception à cette règle observée chez les thiacycloheptines, qui s'explique par la plus grande longueur de la liaison CS par rapport à la CC.
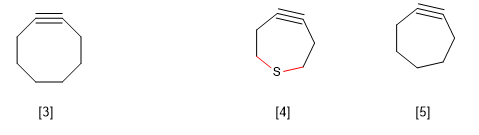
[3] Cyclooctine
[4] La plus grande longueur des liaisons CS par rapport au CC permet l'existence de cet alcyne cyclique.
[5 ] N'existe pas
C) Rigidité des vélos.
La rigidité des bicilles, l'impossibilité de tourner, empêche certaines résonances, donnant lieu à des propriétés anormales dans la molécule. Les amides délocalisent les paires isolées de l'azote en oxygène carbonyle, ce qui supprime la basicité de l'azote. Cependant, lorsque l'amide fait partie d'un système bicyclique, cette affectation n'est pas viable et l'azote apparaît fortement basique.
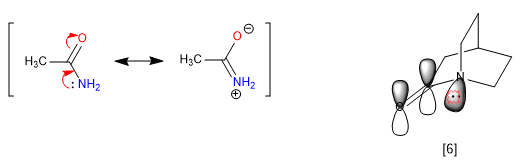
[6] La paire d'azote ne peut pas être transférée, car son orbitale n'est pas parallèle à celle du carbonyle.
L'azote 1-azabicyclo[2.2.2]octane présente une basicité remarquable comparable aux amines aromatiques, avec un pKa pour son acide conjugué de 5,3. Les données spectroscopiques pour cet amide sont également uniques. Ainsi le carbonyle absorbe à 1762 cm -1 , plus typique d'une cétone stressée que d'un amide. L'explication réside encore une fois dans l'impossibilité de transférer le couple libre d'azote.
D) Équilibre conformationnel dans les anneaux à deux membres .
La longueur de liaison plus courte CO par rapport à CC introduit certaines particularités dans les équilibres conformationnels des hétérocycles à six chaînons avec l'oxygène.
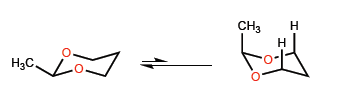
Les courtes distances de CO amènent le méthyle à se rapprocher des hydrogènes en position 3, donnant lieu à des interactions 1,3-diaxiales qui déplacent l'équilibre conformationnel complètement vers la gauche.
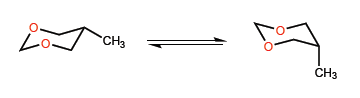
Dans ce deuxième exemple, la situation change, car l'interaction entre les paires isolées méthyle et oxygène n'est pas très importante, et un groupement tert-butyle peut même être situé en position axiale.