En este apartado vamos a estudiar la influencia de las tensiones anulares en las propiedades de los heterociclos.
A) Tensión angular en heterociclos pequeños (3 y 4 miembros).
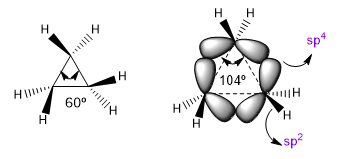
Los ángulos de enlace naturales de un carbono sp3 son de 109,5o, sim embargo en ciclos de tres miembros este ángulo disminuye a 60o, lo que produce una enorme tensión. Para aliviar esta tensión los enlaces entre carbonos dejan de ser rectos, doblándose, dando lugar a unos enlaces curvos denominados "enlaces banana". Los ángulos que forman estos enlaces son de 104o, una discrepancia más tolerable.
| Hibridación | Angulo de enlace |
| sp sp2 sp3 sp4 |
180º 120º 109.5º 104º |
Esta situación hace que los enlaces C-C tiendan a una teórica hibridación sp4 mientras que los C-H tienen a sp2. Estas hibridaciones nos permitirán explicar variaciones en propiedades espectroscópicas y de basicidad. En los espectros de infrarrojo se observa que a medida que disminuye el caracter p de un enlace la absorción se desplaza hacia mayor número de ondas. Comparemos amidas no cíclicas con lactamas tensionadas para ver este efecto.
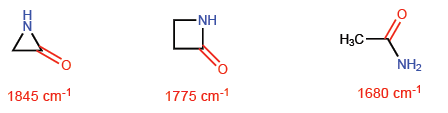
En la azetidin-2-ona el caracter p del enlace C=O es menor que en las otras moléculas y por ello la absorción de radiación infrarroja se desplaza hacia mayor número de ondas.
Otra propiedad que se ve influenciada por la tensión de estos heterociclos es la basicidad. Un aumento del carácter p del par libre produce una disminución en la basicidad. Así entre una amina cíclica y una acíclica la cíclica es menos básica.
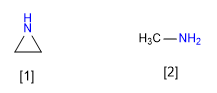
[1 ] Aziridina
[2 ] Metilamina
La aziridina es menos básica que la metilamina. La hibridación del par libre de la aziridina se aproxima a sp2 mientras que el de la metilamina es sp3. El menor caracter p de la aziridina la convierte en menos básica.
B) Tensión anular en anillos grandes. Es sabido que el ciclooctino es el alquino cíclico de menor tamaño que tiene existencia. Los cicloalquinos más pequeños producen una distorsión en el ángulo de enlace correspondiente a la hibridacion sp, generando una tensión en la molécula que la hace inviable.
Sin embargo, existe una excepción a esta regla observada en los tiacicloheptinos, que se explica por la mayor longitud del enlace C-S frente al C-C.
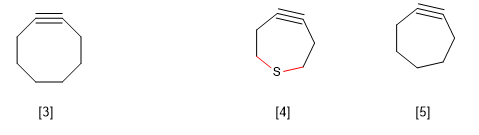
[3 ] Ciclooctino
[4 ] La mayor longitud de los enlaces C-S frente a los C-C permite la existencia de este alquino cíclico.
[5 ] No existe
C) Rigidez de biciclos.
La rigidez de los bicilos, imposibilidad de giro, impide algunas resonacias dando lugar a propiedades anómalas en la molécula. Las amidas deslocalizan pares libres del nitrógeno hacia el oxígeno carbonílico, lo cual elimina la basicidad del nitrógeno. Sin embargo, cuando la amida forma parte de un sistema bicíclico esta cesión no es viable y el nitrógeno se muestra fuertemente básico.
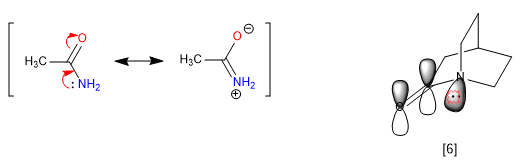
[6 ] El par del nitrógeno no puede cederse, debido a que su orbital no está paralelo al del carbonilo.
El nitrógeno del 1-azabiciclo[2.2.2]octano presenta una notable basicidad comparable a las amina arómáticas, con un pKa para su ácido conjugado de 5.3. Los datos espectroscópicos de esta amida también son singulares. Así el carbonilo absorbe a 1762 cm-1, más típico de una cetona tensionada que de una amida. La explicación vuelve a estar en la imposibilidad de cesión del par libre del nitrógeno.
D) Equilibrio conformacional en anillos de sis miembros.
La menor longitud del enlace C-O frente al C-C introduce ciertas peculiaridades en los equilbrios conformacionales de heterociclos de seis miembros con oxígeno.
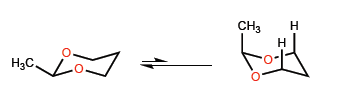
Las cortas distancias C-O hacen que el metilo se acerque a los hidrógenos de la posición 3, dando lugar a unas interacciones 1,3-diaxiales que desplazan el equilibrio conformacional completamente hacia la izquierda.
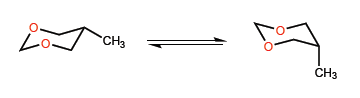
En este segundo ejemplo la situación cambia, dado que la interacción entre el metilo y los pares solitarios del oxígeno es poco importante, pudiendo incluso situarse un grupo tert-butilo en posición axial.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?






