In diesem Abschnitt untersuchen wir den Einfluss ringförmiger Spannungen auf die Eigenschaften von Heterocyclen.
A) Winkelspannung in kleinen Heterocyclen (3 und 4 Mitglieder).
Die natürlichen Bindungswinkel eines sp 3 -Kohlenstoffs betragen 109,5°, jedoch verringert sich dieser Winkel in dreigliedrigen Zyklen auf 60°, was eine enorme Spannung erzeugt. Um diese Spannung zu verringern, sind die Bindungen zwischen Kohlenstoffen nicht mehr gerade, sondern biegen sich, wodurch gekrümmte Bindungen entstehen, die als "Bananenbindungen" bezeichnet werden. Die durch diese Bindungen gebildeten Winkel betragen 104°, eine erträglichere Abweichung.
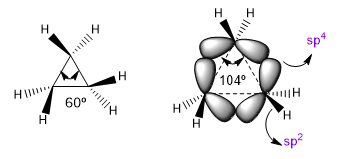
| Hybridisierung | Bindungswinkel |
| sp sp2 sp 3 sp 4 | 180º 120º 109,5º 104. |
Diese Situation führt dazu, dass CC-Bindungen zu einer theoretischen sp 4 -Hybridisierung neigen, während CH-Bindungen sp 2 haben. Diese Hybridisierungen werden es uns ermöglichen, Variationen in spektroskopischen und Basizitätseigenschaften zu erklären. In den Infrarotspektren wird beobachtet, dass sich die Absorption mit abnehmendem p-Charakter einer Bindung in Richtung einer größeren Anzahl von Wellen bewegt. Lassen Sie uns nichtzyklische Amide mit gestressten Lactamen vergleichen, um diesen Effekt zu sehen.
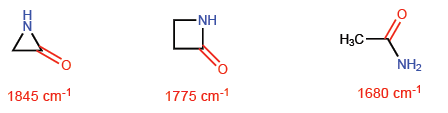
In Azetidin-2-on ist der p-Charakter der C=O-Bindung kleiner als in den anderen Molekülen und daher verschiebt sich die Absorption von Infrarotstrahlung in Richtung einer größeren Wellenzahl.
Eine weitere Eigenschaft, die durch die Spannung dieser Heterocyclen beeinflusst wird, ist die Basizität. Eine Zunahme des p-Charakters des freien Elektronenpaars erzeugt eine Abnahme der Basizität. Somit ist zwischen einem cyclischen und einem acyclischen Amin das cyclische weniger basisch.
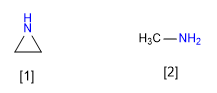
[1] Aziridin
[2] Methylamin
Aziridin ist weniger basisch als Methylamin. Die Einzelpaar-Hybridisierung von Aziridin nähert sich sp2 an, während die von Methylamin sp3 ist. Der kleinere p-Charakter von Aziridin macht es weniger basisch.
B) Ringspannung in großen Ringen. Cyclooctin ist bekanntlich das kleinste existierende cyclische Alkin. Die kleinsten Cycloalkine erzeugen eine Verzerrung des Bindungswinkels, die der sp-Hybridisierung entspricht, wodurch eine Spannung im Molekül erzeugt wird, die sie unmöglich macht.
Bei Thiacycloheptinen wird jedoch eine Ausnahme von dieser Regel beobachtet, die durch die größere Länge der CS-Bindung im Vergleich zur CC-Bindung erklärt wird.
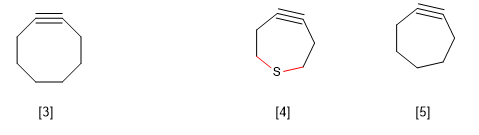
[3] Cyclooctin
[4 ] Die größere Länge der CS-Bindungen im Vergleich zu den CC-Bindungen ermöglicht die Existenz dieses cyclischen Alkins.
[5 ] Existiert nicht
C) Steifigkeit von Fahrrädern.
Die Starrheit der Bicilli, die Unmöglichkeit, sich zu drehen, verhindert einige Resonanzen, was zu anomalen Eigenschaften im Molekül führt. Amide delokalisieren freie Elektronenpaare von Stickstoff zu Carbonylsauerstoff, wodurch die Basizität von Stickstoff entfernt wird. Wenn das Amid jedoch Teil eines bicyclischen Systems ist, ist diese Zuordnung nicht praktikabel und der Stickstoff erscheint stark basisch.
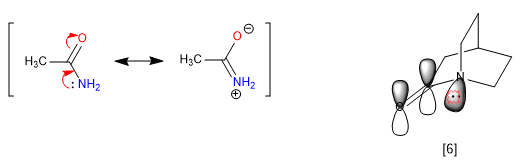
[6] Das Stickstoffpaar kann nicht übertragen werden, da sein Orbital nicht parallel zu dem des Carbonyls ist.
Der 1-Azabicyclo[2.2.2]octan-Stickstoff weist eine bemerkenswerte Basizität auf, die mit aromatischen Aminen vergleichbar ist, mit einem pKa für seine konjugierte Säure von 5,3. Auch die spektroskopischen Daten für dieses Amid sind einzigartig. Somit absorbiert das Carbonyl bei 1762 cm –1 , was eher für ein gestresstes Keton als für ein Amid typisch ist. Die Erklärung liegt wiederum in der Unmöglichkeit, das freie Stickstoffpaar zu übertragen.
D) Konformationsgleichgewicht in sis-gliedrigen Ringen .
Die kürzere Bindungslänge CO im Vergleich zu CC führt zu gewissen Besonderheiten in den Konformationsgleichgewichten sechsgliedriger Heterocyclen mit Sauerstoff.
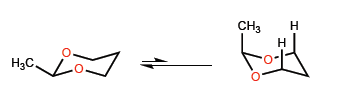
Die kurzen CO-Abstände bewirken, dass sich das Methyl näher an die Wasserstoffatome in 3-Position bewegt, was zu 1,3-diaxialen Wechselwirkungen führt, die das Konformationsgleichgewicht ganz nach links verschieben.
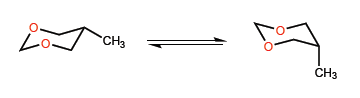
In diesem zweiten Beispiel ändert sich die Situation, da die Wechselwirkung zwischen Methyl- und Sauerstoff-Einzelpaaren nicht sehr wichtig ist und eine tert-Butylgruppe sogar in einer axialen Position lokalisiert sein kann.