ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 84337
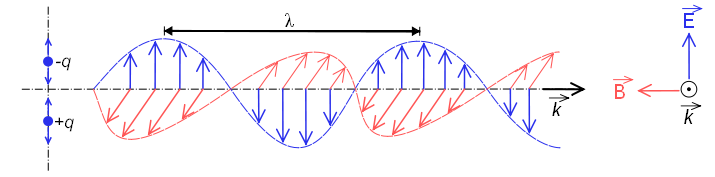
A espectroscopia estuda a interação entre a radiação eletromagnética e a matéria. Nessa interação, a radiação eletromagnética pode se comportar como onda ou como partícula, embora nenhum fenômeno físico tenha sido observado em que ambos os comportamentos ocorram simultaneamente.
Quando se comporta como uma onda, é formado por um campo elétrico e um campo magnético que oscilam perpendicularmente e se propagam na velocidade da luz $c=300000\;km/s$
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 19378
Existem três zonas do espectro eletromagnético com especial interesse na determinação de compostos químicos:
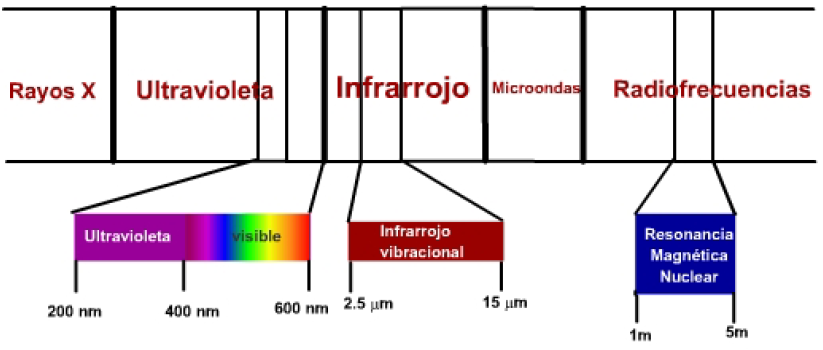
- A radiação visível-ultravioleta tem energia adequada para produzir transições de elétrons moleculares em níveis de energia mais elevados. É a chamada espectroscopia UV, cuja utilidade se limita principalmente à determinação de moléculas com insaturações.
- A radiação infravermelha produz transições entre os níveis vibracionais de uma molécula. As ligações entre os átomos de uma molécula não são rígidas, mas vibram em torno de uma posição de equilíbrio, e a radiação infravermelha é capaz de levar essas ligações a níveis de energia vibracional mais elevados. Isso é chamado de espectroscopia de infravermelho (IR).
- As ondas de rádio têm energia suficiente para fazer com que os núcleos atômicos, submetidos a um campo magnético, entrem em ressonância. Essa técnica é chamada de espectroscopia de ressonância magnética nuclear (NMR).
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 28270
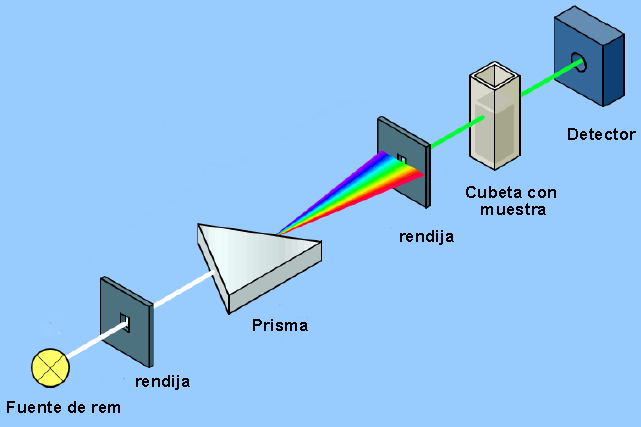
O instrumento que permite detectar a interação entre a radiação eletromagnética e a matéria é denominado espectrofotômetro e sua estrutura básica pode ser vista no diagrama a seguir.
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 40134
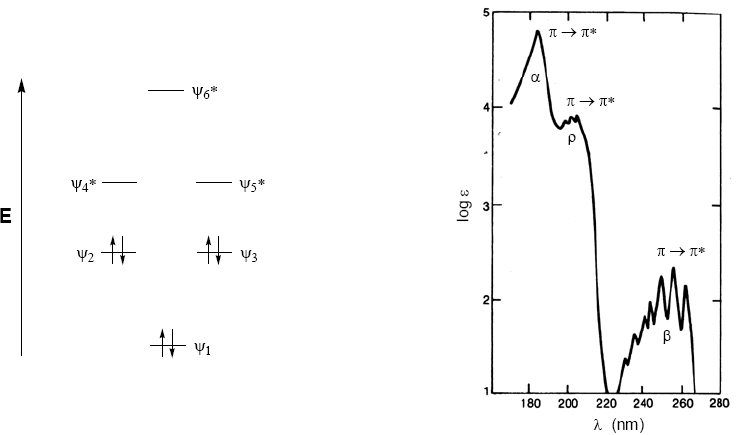
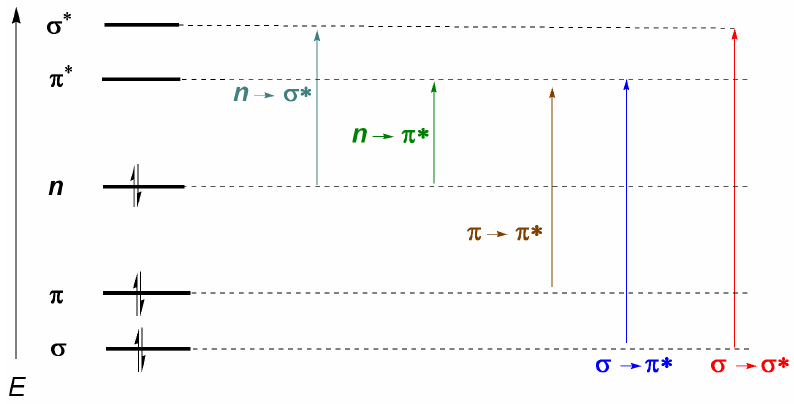
Moléculas orgânicas distribuem seus elétrons em diferentes níveis eletrônicos chamados orbitais moleculares. Os orbitais moleculares de menor energia são $\sigma$, seguidos pelos orbitais $\pi$. Quando na molécula existem átomos com pares eletrônicos livres (oxigênio, enxofre, nitrogênio, halogênios) teremos níveis de não ligação n. Esses níveis eletrônicos estão dispostos na região de ligação do diagrama. Na região antiligante encontramos os orbitais moleculares $\pi^{\ast}$ e $\sigma^{\ast}$. Uma molécula em seu estado fundamental tem orbitais ligantes e não ligantes ocupados e orbitais antiligantes desocupados.
Do que foi discutido acima, pode-se deduzir que as transições eletrônicas devem começar nos orbitais ligantes e não ligantes terminando nos antiligantes. Assim podemos ter os 5 tipos de transições eletrônicas mostradas no diagrama a seguir.
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 49738
A Lei de Lambert-Beer introduz o conceito de absorbância (A) de uma amostra como $A=log\frac{I}{I_0}$. Onde $I_0$ representa a intensidade da luz incidente e I a intensidade da luz que passa pela célula. Também podemos expressar a absorbância em função do comprimento da cubeta e da concentração de soluto. \begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation} Onde $l$ é o comprimento da cubeta em cm, $c$ representa a concentração de soluto em mol/le $\epsilon$ é a absortividade molar (coeficiente de extinção molar) medida em l/mol.cm.
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 24130
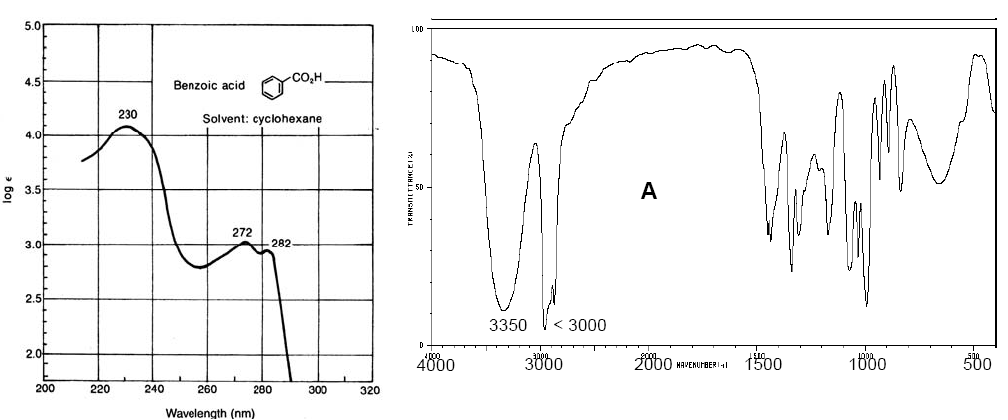 Espectro vis-UV do ácido benzóico (esquerda). Espectro IV do ciclopentanol (à direita)
Espectro vis-UV do ácido benzóico (esquerda). Espectro IV do ciclopentanol (à direita)
Os espectros Vis-UV têm uma resolução menor que o IR porque cada nível eletrônico é dividido em níveis vibracionais e estes por sua vez em níveis rotacionais, de modo que uma transição eletrônica consiste em um grande conjunto de transições rotacionais-vibracionais. Os espectros de infravermelho também possuem bandas de amplitude considerável devido às transições rotacionais que ocorrem simultaneamente com as transições vibracionais.
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 65922
Os grupos cromóforos são os grupos funcionais da molécula responsáveis pela absorção. Principalmente eles são: ligações duplas e triplas carbono-carbono, sistemas aromáticos, grupo carbonila, imino (C=N), diazo (N=N), ligações nitro e CY (Y é um átomo com pares solitários).
Grupos auxocrômicos são substituintes no cromóforo e alteram $\lambda_{max}$ e/ou $\epsilon_{max}$. Os grupos metil, halogênio, hidroxi, alcoxi e amino são auxocromos.
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 34061
- Alcanos. Suas bandas de absorção são devidas às transições $\sigma\rightarrow\sigma^{\ast}$ das ligações CC e CH. Essas transições são de alta energia e ocorrem em comprimentos de onda abaixo de 150 nm, portanto não observáveis em espectrofotômetros convencionais. Essa característica permite que sejam utilizados como solventes para a amostra a ser analisada, pois não interferem em seus sinais.
- Alcenos e alcinos. Eles mostram bandas de absorção devido às transições $\pi\rightarrow\pi^{\ast}$ da ligação tripla CC. Esta transição é de menor energia do que no caso dos alcanos e aparece em comprimentos de onda mais longos (alcenos: 175 nm; alcinos: 170 nm). A ligação dupla e tripla são os grupos cromóforos dessas moléculas.
- Éteres, tióis, sulfetos, aminas: Neste caso, o grupo cromóforo é formado pelo heteroátomo (O,S,N) e os átomos que o ligam. O heteroátomo apresenta pares solitários e a transição que produz a absorção é $n\rightarrow\sigma^{\ast}$. Essa banda de absorção aparece em torno de 175-200 nm para álcoois, éteres e aminas, movendo-se para 200-220 nm para sulfetos.
- Aldeídos, cetonas, ácidos e derivados. O grupo cromóforo desses compostos é carbonila (C=O). Como o oxigênio tem pares isolados, a transição com menor energia é $n\rightarrow\pi^{\ast}$, mas é uma transição proibida ($\epsilon_{max}=15$), pois não há sobreposição entre os orbitais envolvidos. A próxima transição de energia mais baixa é $\pi\rightarrow\pi^{\ast}$, observável em $\lambda_{max}=188\;nm$, com uma absortividade molar de 900.
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 23758
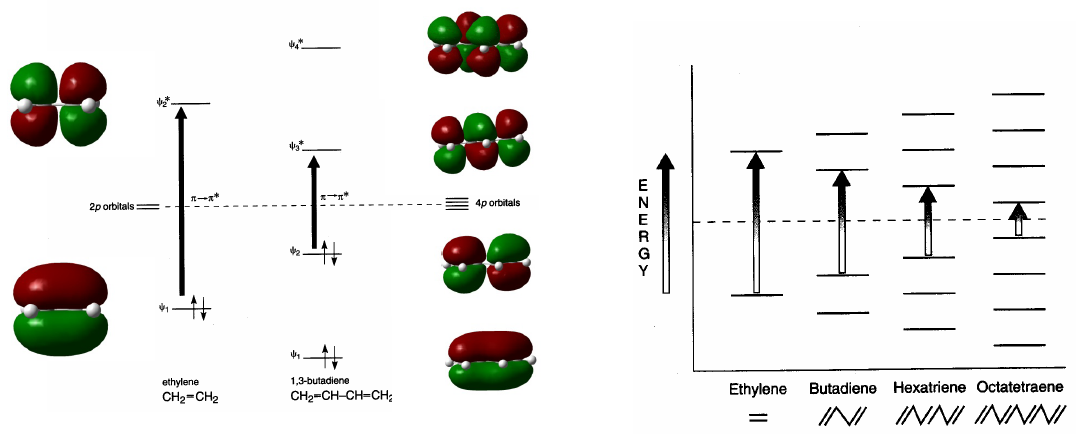
Os sistemas conjugados absorvem em comprimentos de onda mais longos do que os não conjugados. À medida que a conjugação aumenta, a diferença de energia entre HOMO e LUMO diminui e a radiação necessária para produzir a transição $\pi \rightarrow \pi^{\ast}$ diminui seu comprimento de onda.
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 16117
O diagrama de orbitais moleculares \alpha,\beta$-insaturados é construído a partir dos orbitais moleculares do eteno e da carbonila
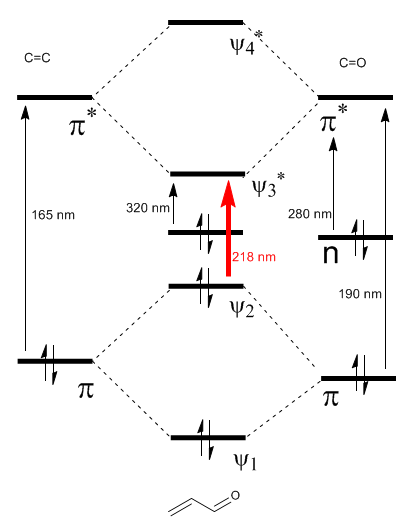
Ler mais: Efeito batocrômico em carbonilas $\alpha,\beta$-insaturadas
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 15465
Como pode ser visto no diagrama, a conjugação com os pares solitários do grupo X produz uma aproximação entre os orbitais HOMO e LUMO, dando origem a uma transição de menor energia (maior comprimento de onda) do que no eteno.
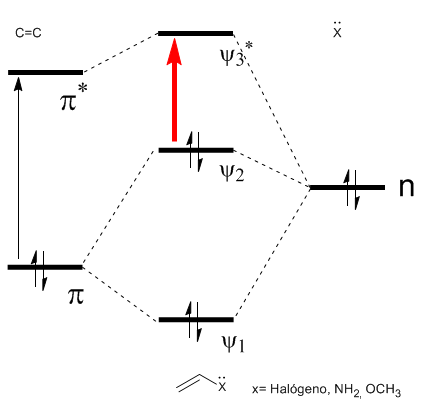
- Detalhes
- Germán Fernández
- ESPECTROSCOPIA VISÍVEL-ULTRAVIOLETA (VIS/UV)
- Acessos: 25431
O espectro de absorção do benzeno consiste em três bandas em 184, 204 e 256 nm, frequentemente chamadas de $\alpha$, p e $\beta$. As bandas $\alpha$, p também são conhecidas como primárias e $\beta$ secundárias. A banda secundária é larga devido à sua estrutura vibracional.