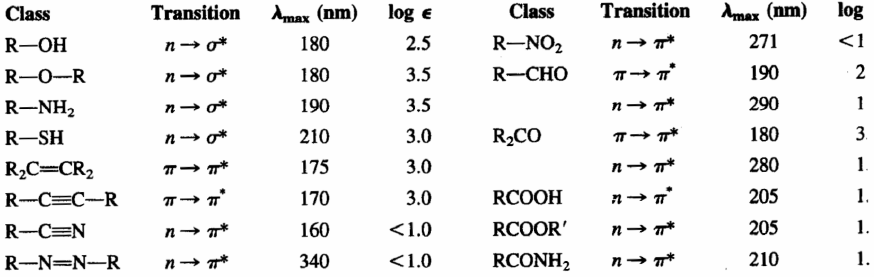
- Alcanos. Suas bandas de absorção são devidas às transições $\sigma\rightarrow\sigma^{\ast}$ das ligações CC e CH. Essas transições são de alta energia e ocorrem em comprimentos de onda abaixo de 150 nm, portanto não observáveis em espectrofotômetros convencionais. Essa característica permite que sejam utilizados como solventes para a amostra a ser analisada, pois não interferem em seus sinais.
- Alcenos e alcinos. Eles mostram bandas de absorção devido às transições $\pi\rightarrow\pi^{\ast}$ da ligação tripla CC. Esta transição é de menor energia do que no caso dos alcanos e aparece em comprimentos de onda mais longos (alcenos: 175 nm; alcinos: 170 nm). A ligação dupla e tripla são os grupos cromóforos dessas moléculas.
- Éteres, tióis, sulfetos, aminas: Neste caso, o grupo cromóforo é formado pelo heteroátomo (O,S,N) e os átomos que o ligam. O heteroátomo apresenta pares solitários e a transição que produz a absorção é $n\rightarrow\sigma^{\ast}$. Essa banda de absorção aparece em torno de 175-200 nm para álcoois, éteres e aminas, movendo-se para 200-220 nm para sulfetos.
- Aldeídos, cetonas, ácidos e derivados. O grupo cromóforo desses compostos é carbonila (C=O). Como o oxigênio tem pares isolados, a transição com menor energia é $n\rightarrow\pi^{\ast}$, mas é uma transição proibida ($\epsilon_{max}=15$), pois não há sobreposição entre os orbitais envolvidos. A próxima transição de energia mais baixa é $\pi\rightarrow\pi^{\ast}$, observável em $\lambda_{max}=188\;nm$, com uma absortividade molar de 900.
A tabela a seguir mostra as absorções dos principais grupos cromóforos.