SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 84489
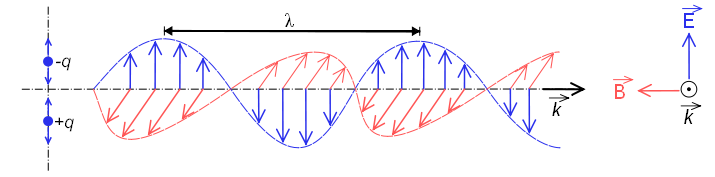
La spectroscopie étudie l'interaction entre le rayonnement électromagnétique et la matière. Dans cette interaction, le rayonnement électromagnétique peut se comporter comme une onde ou comme une particule, bien qu'aucun phénomène physique n'ait été observé dans lequel les deux comportements se produisent simultanément.
Lorsqu'il se comporte comme une onde, il est composé d'un champ électrique et d'un champ magnétique qui oscillent perpendiculairement et se propagent à la vitesse de la lumière $c=300000\;km/s$
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 19654
Il existe trois zones du spectre électromagnétique présentant un intérêt particulier pour la détermination des composés chimiques :
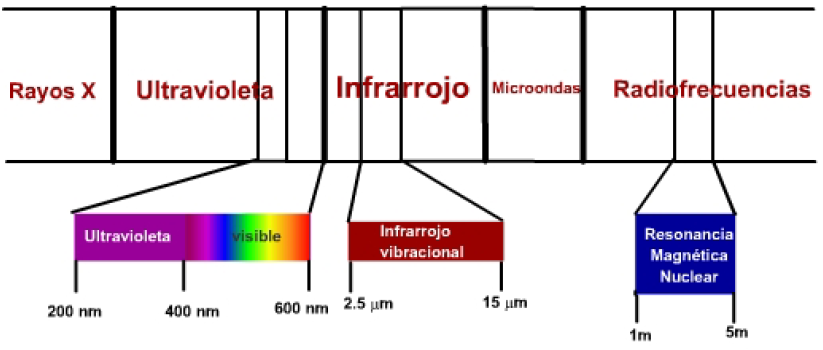
- Le rayonnement visible-ultraviolet a une énergie adéquate pour produire des transitions d'électrons moléculaires à des niveaux d'énergie plus élevés. Il s'agit de la spectroscopie dite UV, dont l'utilité se limite principalement à la détermination de molécules présentant des insaturations.
- Le rayonnement infrarouge produit des transitions entre les niveaux vibrationnels d'une molécule. Les liaisons entre les atomes d'une molécule ne sont pas rigides, mais vibrent autour d'une position d'équilibre, et le rayonnement infrarouge est capable d'amener ces liaisons à des niveaux d'énergie vibratoire plus élevés. C'est ce qu'on appelle la spectroscopie infrarouge (IR).
- Les ondes radio ont une énergie suffisante pour faire résonner les noyaux atomiques, soumis à un champ magnétique. Cette technique est appelée spectroscopie par résonance magnétique nucléaire (RMN).
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 28466
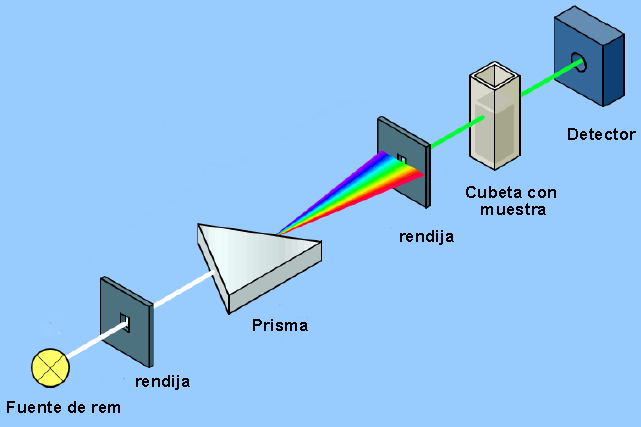
L'instrument qui permet de détecter l'interaction entre le rayonnement électromagnétique et la matière s'appelle un spectrophotomètre et sa structure de base peut être vue dans le schéma suivant.
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 41492
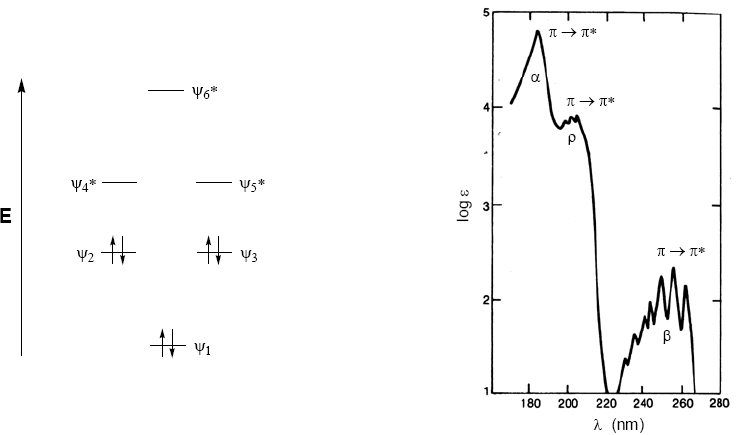
Les molécules organiques distribuent leurs électrons dans différents niveaux électroniques appelés orbitales moléculaires. Les orbitales moléculaires de plus basse énergie sont $\sigma$, suivies des orbitales $\pi$. Lorsque dans la molécule il y a des atomes avec des paires électroniques libres (oxygène, soufre, azote, halogènes), nous aurons des niveaux non liés n. Ces niveaux électroniques sont disposés dans la zone de liaison du schéma. Dans la région antiliante, nous trouvons les orbitales moléculaires $\pi^{\ast}$ et $\sigma^{\ast}$. Une molécule dans son état fondamental a des orbitales liantes et non liantes occupées et des orbitales antiliantes inoccupées.
De ce qui a été discuté ci-dessus, on peut déduire que les transitions électroniques doivent partir des orbitales liantes et non liantes se terminant par les orbitales antiliantes. Ainsi on peut avoir les 5 types de transitions électroniques représentés dans le schéma suivant.
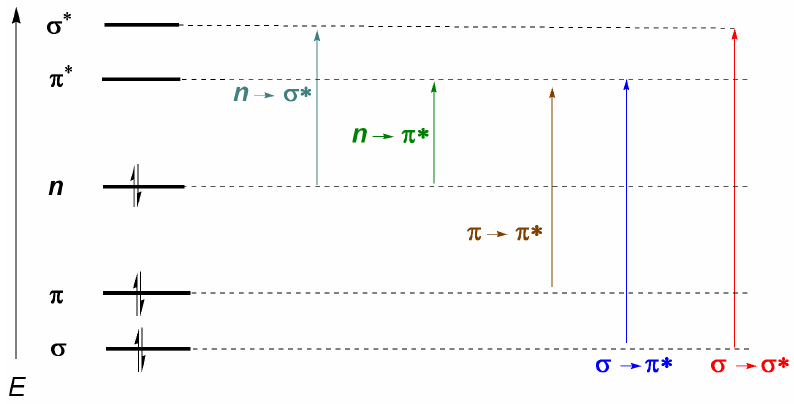
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 49771
La loi de Lambert-Beer introduit le concept d'absorbance (A) d'un échantillon sous la forme $A=log\frac{I}{I_0}$. Où $I_0$ représente l'intensité de la lumière incidente et I l'intensité de la lumière traversant la cellule. Nous pouvons également exprimer l'absorbance en fonction de la longueur de la cuvette et de la concentration du soluté. \begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation} Où $l$ est la longueur de la cuvette en cm, $c$ représente la concentration de soluté en mol/l et $\epsilon$ est l'absorptivité molaire (coefficient d'extinction molaire) mesurée en l/mol.cm.
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 24119
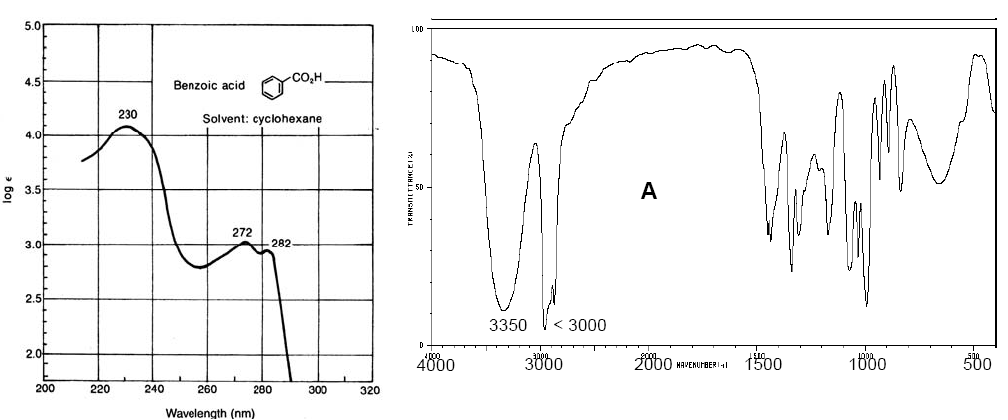 Spectre Vis-UV de l'acide benzoïque (à gauche). Spectre IR du cyclopentanol (à droite)
Spectre Vis-UV de l'acide benzoïque (à gauche). Spectre IR du cyclopentanol (à droite)
Les spectres Vis-UV ont une résolution inférieure à celle de l'IR car chaque niveau électronique est divisé en niveaux vibrationnels et ceux-ci à leur tour en niveaux rotationnels, de sorte qu'une transition électronique consiste en un grand ensemble de transitions rotationnelles-vibrationnelles. Les spectres IR ont également des bandes d'amplitude considérable en raison de transitions rotationnelles qui se produisent simultanément avec des transitions vibrationnelles.
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 65649
Les groupes chromophores sont les groupes fonctionnels de la molécule responsables de l'absorption. Ce sont principalement : les doubles et triples liaisons carbone-carbone, les systèmes aromatiques, le groupe carbonyle, les liaisons imino (C=N), diazo (N=N), nitro et CY (Y est un atome avec des paires isolées).
Les groupes auxochromiques sont des substituants sur le chromophore et modifient $\lambda_{max}$ et/ou $\epsilon_{max}$. Les groupes méthyle, halogène, hydroxy, alcoxy et amino sont des auxochromes.
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 33641
- Alcanes. Ses bandes d'absorption sont dues aux transitions $\sigma\rightarrow\sigma^{\ast}$ des liaisons CC et CH. Ces transitions sont de haute énergie et ont lieu à des longueurs d'onde inférieures à 150 nm, donc non observables dans les spectrophotomètres conventionnels. Cette caractéristique permet de les utiliser comme solvants de l'échantillon à analyser, car ils n'interfèrent pas avec leurs signaux.
- Alcènes et alcynes. Ils montrent des bandes d'absorption dues aux transitions $\pi\rightarrow\pi^{\ast}$ de la triple liaison CC. Cette transition est de plus faible énergie que dans le cas des alcanes et apparaît à des longueurs d'onde plus grandes (alcènes : 175 nm ; alcynes : 170 nm). La double et la triple liaison sont les groupes chromophores de ces molécules.
- Ethers, thiols, sulfures, amines : Dans ce cas, le groupement chromophore est formé par l'hétéroatome (O,S,N) et les atomes qui le relient. L'hétéroatome présente des paires isolées et la transition qui produit l'absorption est $n\rightarrow\sigma^{\ast}$. Cette bande d'absorption apparaît vers 175-200 nm pour les alcools, les éthers et les amines, passant à 200-220 nm pour les sulfures.
- Aldéhydes, cétones, acides et dérivés. Le groupe chromophore de ces composés est le carbonyle (C=O). Puisque l'oxygène a des paires isolées, la transition avec la plus faible énergie est $n\rightarrow\pi^{\ast}$, mais c'est une transition interdite ($\epsilon_{max}=15$), car il n'y a pas de chevauchement entre les orbitales impliquées. La prochaine transition d'énergie la plus basse est $\pi\rightarrow\pi^{\ast}$, observable à $\lambda_{max}=188\;nm$, avec une absorptivité molaire de 900.
Lire la suite : Spectres Vis-UV dans les composés organiques
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 23816
Les systèmes conjugués absorbent à des longueurs d'onde plus longues que les systèmes non conjugués. Au fur et à mesure que la conjugaison augmente, la différence d'énergie entre HOMO et LUMO diminue et le rayonnement nécessaire pour produire la transition $\pi \rightarrow \pi^{\ast}$ diminue sa longueur d'onde.
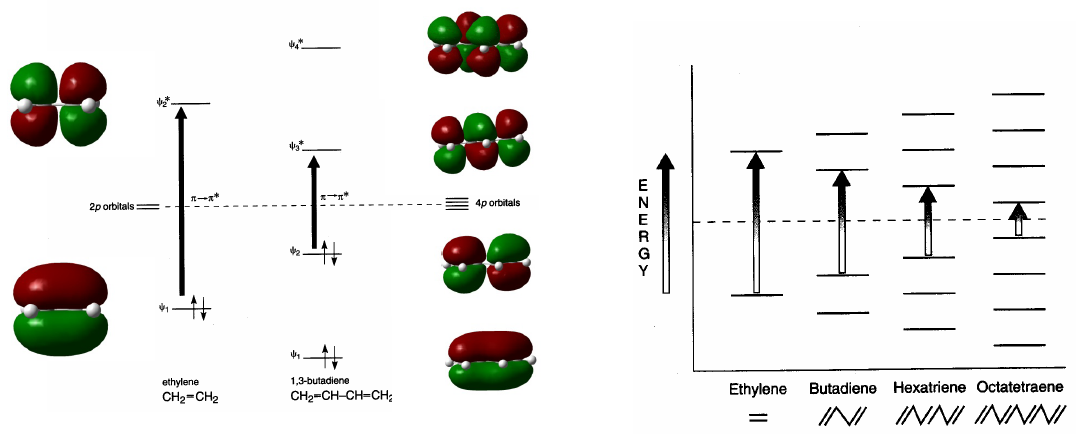
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 15902
Le diagramme orbital moléculaire \alpha,\beta$-insaturé est construit à partir des orbitales moléculaires éthène et carbonyle
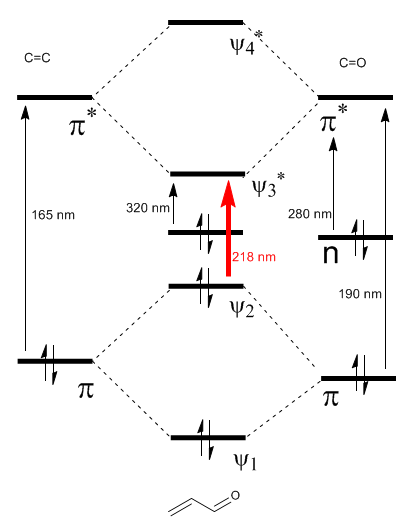
Lire la suite : Effet bathochrome sur les carbonyles $\alpha,\beta$-insaturés
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 15287
Comme on peut le voir sur le diagramme, la conjugaison avec les paires isolées du groupe X produit une approche entre les orbitales HOMO et LUMO, donnant lieu à une transition de plus faible énergie (plus grande longueur d'onde) que dans l'éthène.
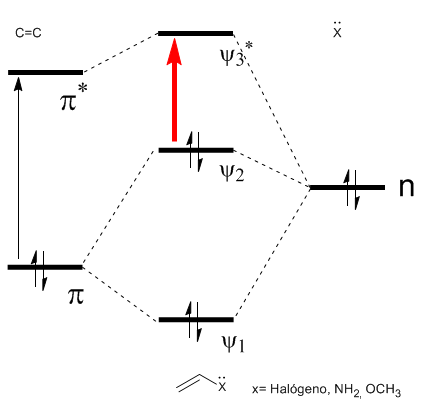
- Détails
- Germán Fernández
- SPECTROSCOPIE VISIBLE-ULTRAVIOLET
- Affichages : 26685
Le spectre d'absorption du benzène se compose de trois bandes à 184, 204 et 256 nm, souvent appelées $\alpha$, p et $\beta$. Les bandes $\alpha$, p sont également appelées bande primaire et bande secondaire $\beta$. La bande secondaire est large en raison de sa structure vibratoire.