SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 84327
Spektroskopi mempelajari interaksi antara radiasi elektromagnetik dan materi. Dalam interaksi ini, radiasi elektromagnetik dapat berperilaku sebagai gelombang atau sebagai partikel, meskipun tidak ada fenomena fisik yang diamati di mana kedua perilaku tersebut terjadi secara bersamaan.
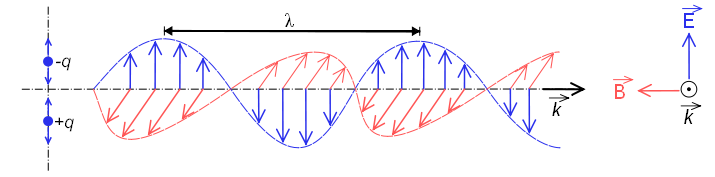
Ketika berperilaku sebagai gelombang, ia terdiri dari medan listrik dan medan magnet yang berosilasi tegak lurus dan merambat dengan kecepatan cahaya $c=300000\;km/s$
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 19537
Ada tiga zona spektrum elektromagnetik dengan minat khusus dalam penentuan senyawa kimia:
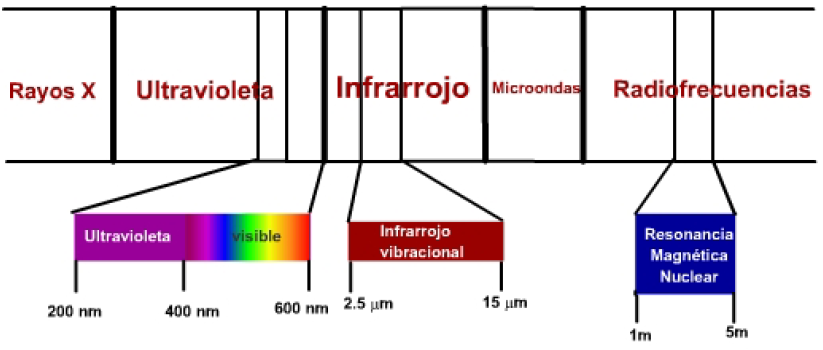
- Radiasi ultraviolet-tampak memiliki energi yang cukup untuk menghasilkan transisi elektron molekuler pada tingkat energi yang lebih tinggi. Inilah yang disebut spektroskopi UV, yang kegunaannya terutama terbatas pada penentuan molekul dengan ketidakjenuhan.
- Radiasi infra merah menghasilkan transisi antara tingkat vibrasi molekul. Ikatan antara atom-atom molekul tidak kaku, tetapi bergetar di sekitar posisi kesetimbangan, dan radiasi infra merah mampu membawa ikatan ini ke tingkat energi vibrasi yang lebih tinggi. Ini disebut spektroskopi inframerah (IR).
- Gelombang radio memiliki energi yang cukup untuk menyebabkan inti atom, yang dikenai medan magnet, beresonansi. Teknik ini disebut spektroskopi resonansi magnetik nuklir (NMR).
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 28229
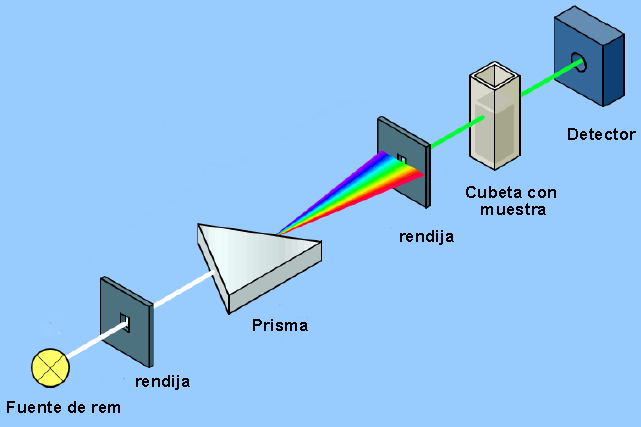
Instrumen yang memungkinkan pendeteksian interaksi antara radiasi elektromagnetik dan materi disebut spektrofotometer dan struktur dasarnya dapat dilihat pada diagram berikut.
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 39770
Molekul organik mendistribusikan elektronnya dalam tingkat elektronik yang berbeda yang disebut orbital molekul. Orbital molekul dengan energi terendah adalah $\sigma$, diikuti oleh orbital $\pi$. Ketika dalam molekul terdapat atom dengan pasangan elektron bebas (oksigen, belerang, nitrogen, halogen) kita akan memiliki tingkat non-ikatan n. Tingkat elektronik ini diatur dalam daerah ikatan diagram. Di daerah antiikatan kita menemukan orbital molekul $\pi^{\ast}$ dan $\sigma^{\ast}$. Molekul dalam keadaan dasarnya memiliki orbital ikatan dan nonikatan yang terisi dan orbital antiikatan kosong.
Dari apa yang telah dibahas di atas, dapat disimpulkan bahwa transisi elektronik harus dimulai dari orbital ikatan dan nonikatan yang diakhiri dengan orbital antiikatan. Dengan demikian kita dapat memiliki 5 jenis transisi elektronik yang ditunjukkan pada diagram berikut.
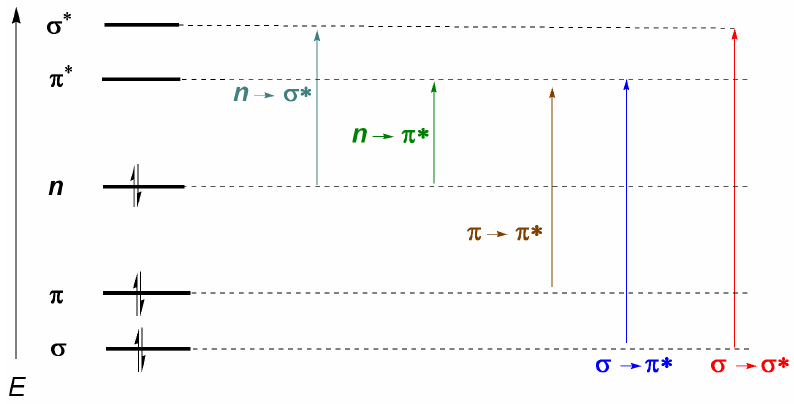
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 49735
Hukum Lambert-Beer memperkenalkan konsep absorbansi (A) sampel sebagai $A=log\frac{I}{I_0}$. Di mana $I_0$ mewakili intensitas cahaya insiden dan I intensitas cahaya yang melewati sel. Kami juga dapat menyatakan absorbansi sebagai fungsi panjang kuvet dan konsentrasi zat terlarut. \begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation} Di mana $l$ adalah panjang kuvet dalam cm, $c$ mewakili konsentrasi zat terlarut dalam mol/l dan $\epsilon$ adalah absorptivitas molar (koefisien kepunahan molar) yang diukur dalam l/mol.cm.
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 23529
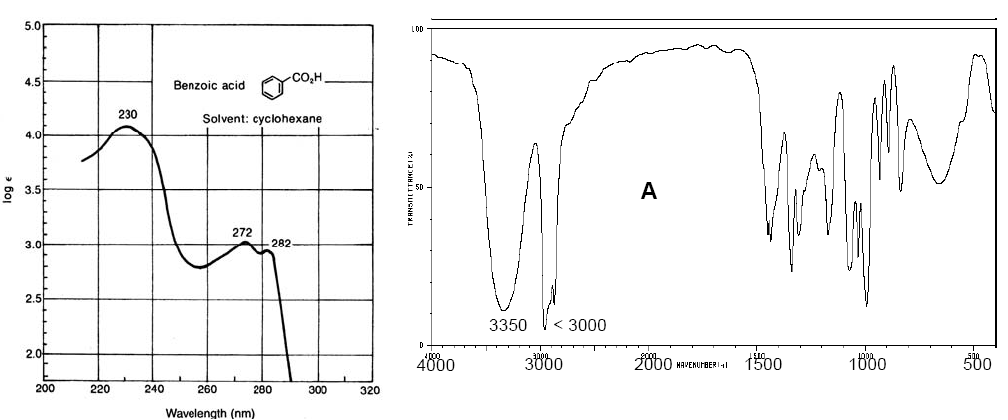 Spektrum Vis-UV asam benzoat (kiri). Spektrum IR siklopentanol (kanan)
Spektrum Vis-UV asam benzoat (kiri). Spektrum IR siklopentanol (kanan)
Spektra Vis-UV memiliki resolusi yang lebih rendah daripada IR karena setiap tingkat elektronik dibagi menjadi tingkat vibrasi dan ini pada gilirannya menjadi tingkat rotasi, sehingga transisi elektronik terdiri dari serangkaian besar transisi getaran rotasi. . Spektra IR juga memiliki pita dengan amplitudo yang cukup besar akibat transisi rotasi yang terjadi bersamaan dengan transisi vibrasi.
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 69200
Kelompok kromofor adalah kelompok fungsional dari molekul yang bertanggung jawab untuk penyerapan. Terutama mereka adalah: ikatan karbon-karbon rangkap dan rangkap tiga, sistem aromatik, gugus karbonil, imino (C=N), diazo (N=N), ikatan nitro dan CY (Y adalah atom dengan pasangan mandiri).
Gugus auksokromik adalah substituen pada kromofor dan mengubah $\lambda_{max}$ dan/atau $\epsilon_{max}$. Gugus metil, halogen, hidroksi, alkoksi, dan amino adalah auxokrom.
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 33891
- Alkana. Pita serapannya disebabkan oleh transisi $\sigma\rightarrow\sigma^{\ast}$ dari ikatan CC dan CH. Transisi ini berenergi tinggi dan berlangsung pada panjang gelombang di bawah 150 nm, sehingga tidak dapat diamati dalam spektrofotometer konvensional. Karakteristik ini memungkinkan mereka untuk digunakan sebagai pelarut untuk sampel yang akan dianalisis, karena mereka tidak mengganggu sinyalnya.
- Alkena dan alkin. Mereka menunjukkan pita serapan karena transisi $\pi\rightarrow\pi^{\ast}$ dari ikatan rangkap tiga CC. Transisi ini memiliki energi yang lebih rendah daripada alkana dan muncul pada panjang gelombang yang lebih panjang (alkena: 175 nm; alkin: 170 nm). Ikatan rangkap dan rangkap tiga adalah gugus kromofor dari molekul-molekul ini.
- Eter, tiol, sulfida, amina: Dalam hal ini, gugus kromofor dibentuk oleh heteroatom (O,S,N) dan atom yang menghubungkannya. Heteroatom menyajikan pasangan mandiri dan transisi yang menghasilkan penyerapan adalah $n\rightarrow\sigma^{\ast}$. Pita serapan ini muncul sekitar 175-200 nm untuk alkohol, eter dan amina, bergerak ke 200-220 nm untuk sulfida.
- Aldehida, keton, asam dan turunannya. Gugus kromofor dari senyawa ini adalah karbonil (C=O). Karena oksigen memiliki pasangan mandiri, transisi dengan energi terendah adalah $n\rightarrow\pi^{\ast}$, tetapi ini adalah transisi terlarang ($\epsilon_{max}=15$), karena tidak ada tumpang tindih antara orbital yang terlibat. Transisi energi terendah berikutnya adalah $\pi\rightarrow\pi^{\ast}$, dapat diamati pada $\lambda_{max}=188\;nm$, dengan absorptivitas molar 900.
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 23366
Sistem terkonjugasi menyerap pada panjang gelombang yang lebih panjang daripada yang tidak terkonjugasi. Saat konjugasi meningkat, perbedaan energi antara HOMO dan LUMO berkurang dan radiasi yang diperlukan untuk menghasilkan transisi $\pi \rightarrow \pi^{\ast}$ menurunkan panjang gelombangnya.
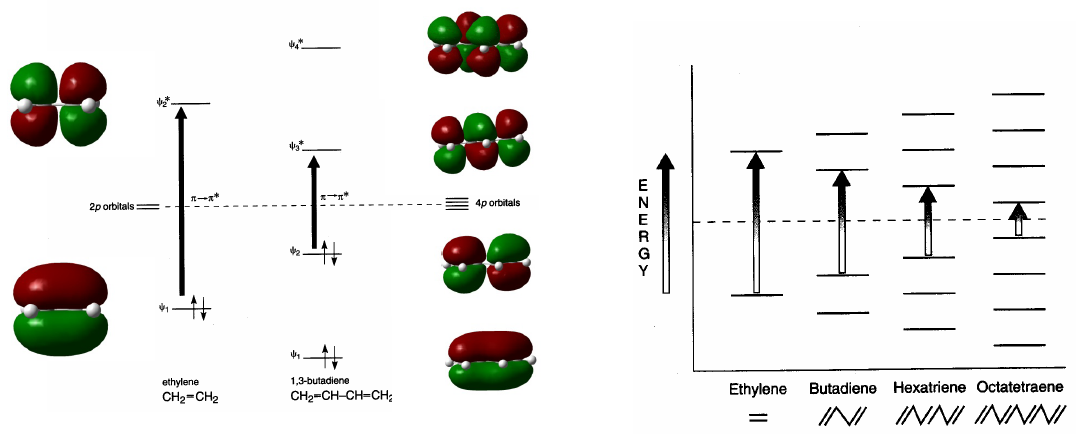
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 16031
Diagram orbital molekul \alpha,\beta$-tak jenuh dibuat dari orbital molekul etena dan karbonil
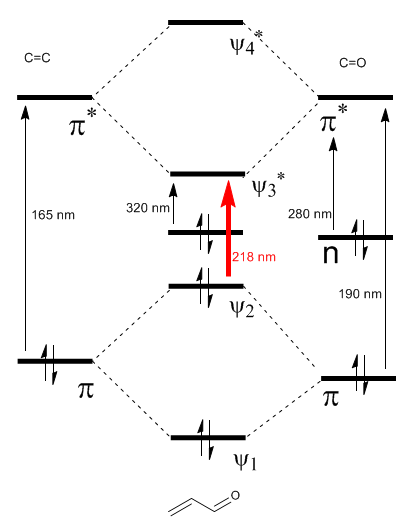
Selengkapnya: Efek batokromik pada $\alpha,\beta$-karbonil tak jenuh
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 15204
Seperti dapat dilihat pada diagram, konjugasi dengan pasangan elektron bebas dari grup X menghasilkan pendekatan antara orbital HOMO dan LUMO, sehingga menimbulkan transisi energi yang lebih rendah (panjang gelombang lebih panjang) dibandingkan dengan etena.
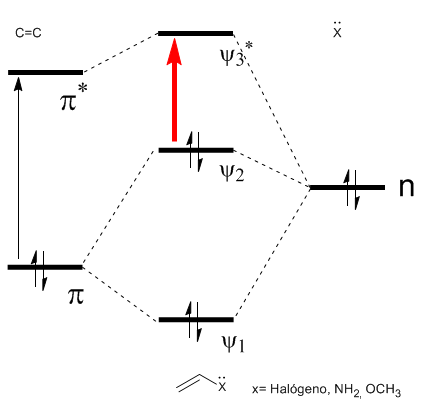
- Detail
- Germán Fernández
- SPEKTROSKOPI ULTRAVIOLET TERLIHAT
- Dilihat: 25095
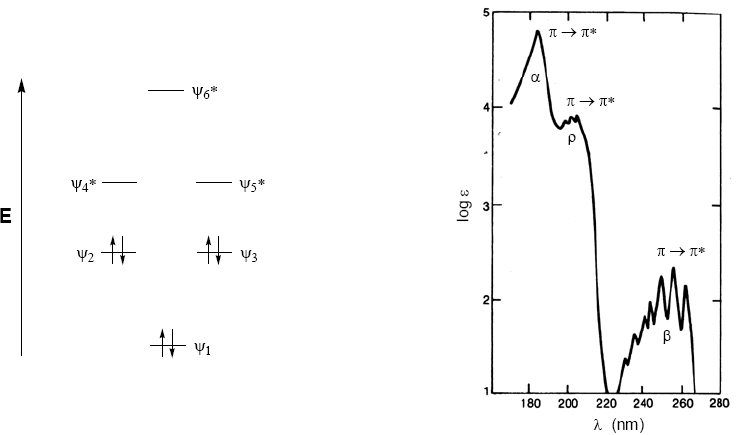
Spektrum serapan benzena terdiri dari tiga pita pada 184, 204, dan 256 nm, sering disebut $\alpha$, p, dan $\beta$. Pita $\alpha$, p juga dikenal sebagai pita primer dan pita sekunder $\beta$. Pita sekunder lebar karena struktur getarannya.