ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 84320
Die Spektroskopie untersucht die Wechselwirkung zwischen elektromagnetischer Strahlung und Materie. Bei dieser Wechselwirkung kann sich elektromagnetische Strahlung wie eine Welle oder wie ein Teilchen verhalten, obwohl kein physikalisches Phänomen beobachtet wurde, bei dem beide Verhaltensweisen gleichzeitig auftreten.
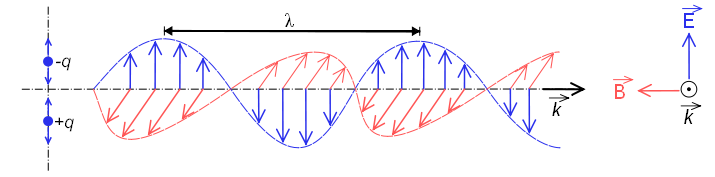
Wenn es sich wie eine Welle verhält, besteht es aus einem elektrischen Feld und einem magnetischen Feld, die senkrecht zueinander schwingen und sich mit Lichtgeschwindigkeit $c=300000\;km/s$ ausbreiten
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 19543
Es gibt drei Zonen des elektromagnetischen Spektrums, die für die Bestimmung chemischer Verbindungen von besonderem Interesse sind:
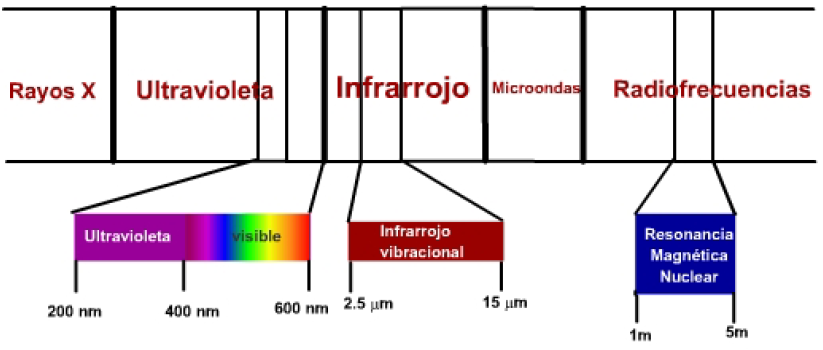
- Sichtbare ultraviolette Strahlung hat eine ausreichende Energie, um molekulare Elektronenübergänge bei höheren Energieniveaus zu erzeugen. Es ist die sogenannte UV-Spektroskopie, deren Nützlichkeit hauptsächlich auf die Bestimmung von Molekülen mit Ungesättigtheiten beschränkt ist.
- Infrarotstrahlung erzeugt Übergänge zwischen Schwingungsniveaus eines Moleküls. Die Bindungen zwischen den Atomen eines Moleküls sind nicht starr, sondern schwingen um eine Gleichgewichtsposition herum, und Infrarotstrahlung ist in der Lage, diese Bindungen auf höhere Schwingungsenergieniveaus zu bringen. Dies wird als Infrarot (IR)-Spektroskopie bezeichnet.
- Radiowellen haben ausreichend Energie, um Atomkerne, die einem Magnetfeld ausgesetzt sind, in Resonanz zu versetzen. Diese Technik wird Kernspinresonanz (NMR)-Spektroskopie genannt.
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 28724
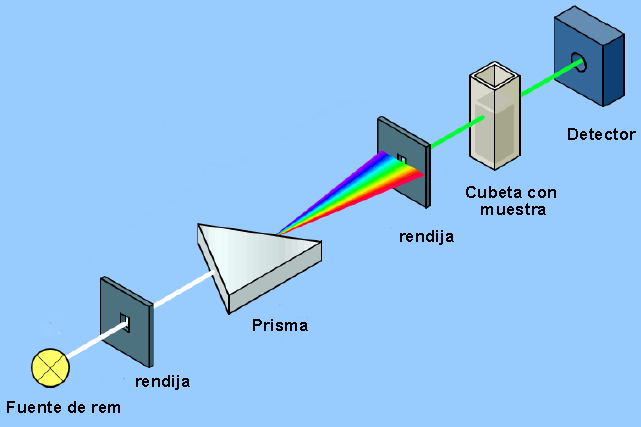
Das Instrument, mit dem die Wechselwirkung zwischen elektromagnetischer Strahlung und Materie nachgewiesen werden kann, wird als Spektrophotometer bezeichnet und sein grundlegender Aufbau ist aus dem folgenden Diagramm ersichtlich.
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 39659
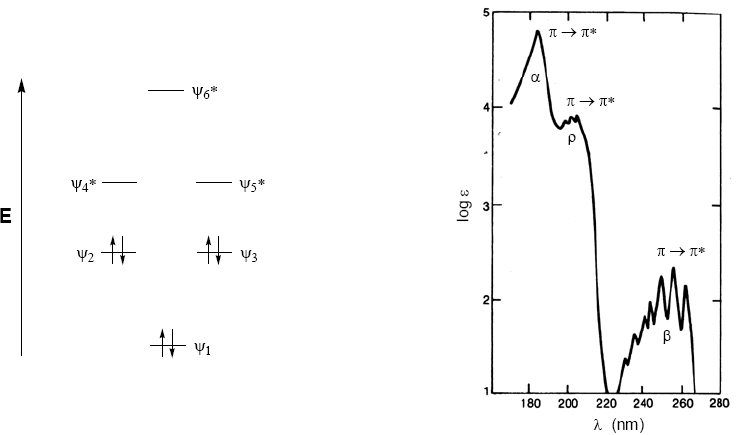
Organische Moleküle verteilen ihre Elektronen in verschiedenen elektronischen Ebenen, die als Molekülorbitale bezeichnet werden. Die Molekülorbitale mit der niedrigsten Energie sind $\sigma$, gefolgt von $\pi$-Orbitalen. Wenn im Molekül Atome mit freien Elektronenpaaren (Sauerstoff, Schwefel, Stickstoff, Halogene) vorhanden sind, haben wir nichtbindende Ebenen n. Diese elektronischen Ebenen sind im Verbindungsbereich des Diagramms angeordnet. Im antibindenden Bereich finden wir die Molekülorbitale $\pi^{\ast}$ und $\sigma^{\ast}$. Ein Molekül in seinem Grundzustand hat besetzte bindende und nichtbindende Orbitale und unbesetzte antibindende Orbitale.
Aus dem oben Erläuterten lässt sich ableiten, dass die elektronischen Übergänge von den bindenden und nichtbindenden Orbitalen ausgehen und in den antibindenden enden müssen. Somit können wir die 5 Arten von elektronischen Übergängen haben, die im folgenden Diagramm gezeigt werden.
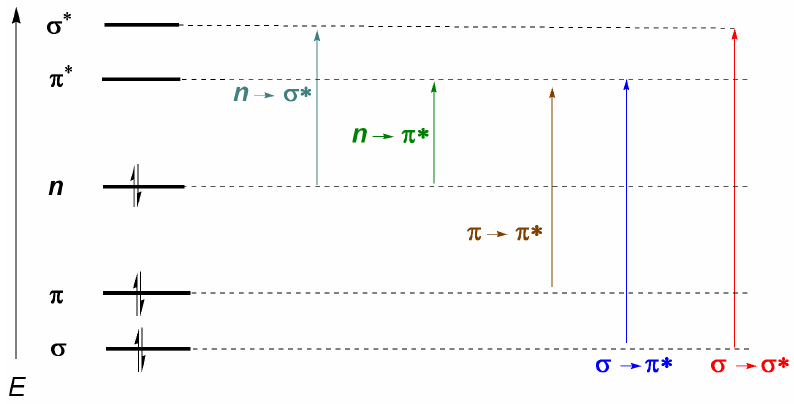
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 49864
Das Lambert-Beer-Gesetz führt das Konzept der Extinktion (A) einer Probe als $A=log\frac{I}{I_0}$ ein. Wobei $I_0$ die Intensität des einfallenden Lichts darstellt und I die Intensität des Lichts, das durch die Zelle geht. Wir können die Extinktion auch als Funktion der Küvettenlänge und der Konzentration des gelösten Stoffes ausdrücken. \begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation} Wobei $l$ die Länge der Küvette in cm ist, $c$ die Konzentration von gelöster Stoff in mol/l und $\epsilon$ ist das molare Absorptionsvermögen (molarer Extinktionskoeffizient), gemessen in l/mol.cm.
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 23700
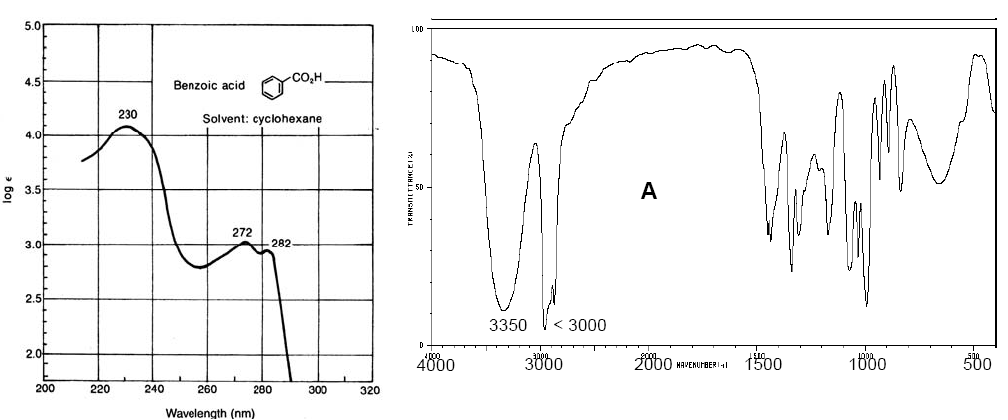 Vis-UV-Spektrum von Benzoesäure (links). IR-Spektrum von Cyclopentanol (rechts)
Vis-UV-Spektrum von Benzoesäure (links). IR-Spektrum von Cyclopentanol (rechts)
Vis-UV-Spektren haben eine geringere Auflösung als IR, da jedes elektronische Niveau in Schwingungsniveaus und diese wiederum in Rotationsniveaus unterteilt ist, sodass ein elektronischer Übergang aus einer großen Menge von Rotations-Vibrations-Übergängen besteht. IR-Spektren weisen aufgrund von Rotationsübergängen, die gleichzeitig mit Schwingungsübergängen auftreten, auch Bänder mit beträchtlicher Amplitude auf.
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 62637
Chromophorgruppen sind die für die Absorption verantwortlichen funktionellen Gruppen des Moleküls. Hauptsächlich sind dies: Kohlenstoff-Kohlenstoff-Doppel- und -Dreifachbindungen, aromatische Systeme, Carbonylgruppen, Imino- (C=N), Diazo- (N=N), Nitro- und CY-Bindungen (Y ist ein Atom mit freien Elektronenpaaren).
Auxochrome Gruppen sind Substituenten am Chromophor und verändern $\lambda_{max}$ und/oder $\epsilon_{max}$. Die Methyl-, Halogen-, Hydroxy-, Alkoxy- und Aminogruppen sind Auxochrome.
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 33502
- Alkane. Seine Absorptionsbanden sind auf $\sigma\rightarrow\sigma^{\ast}$-Übergänge von CC- und CH-Bindungen zurückzuführen. Diese Übergänge sind hochenergetisch und finden bei Wellenlängen unter 150 nm statt und sind daher in herkömmlichen Spektrophotometern nicht beobachtbar. Aufgrund dieser Eigenschaft können sie als Lösungsmittel für die zu analysierende Probe verwendet werden, da sie ihre Signale nicht stören.
- Alkene und Alkine. Sie zeigen Absorptionsbanden aufgrund von $\pi\rightarrow\pi^{\ast}$-Übergängen der CC-Dreifachbindung. Dieser Übergang ist energieärmer als bei Alkanen und tritt bei größeren Wellenlängen auf (Alkene: 175 nm; Alkine: 170 nm). Die Doppel- und Dreifachbindung sind die Chromophorgruppen dieser Moleküle.
- Ether, Thiole, Sulfide, Amine: In diesem Fall wird die chromophore Gruppe durch das Heteroatom (O,S,N) und die Atome, die es verbinden, gebildet. Das Heteroatom präsentiert freie Elektronenpaare und der Übergang, der die Absorption erzeugt, ist $n\rightarrow\sigma^{\ast}$. Diese Absorptionsbande erscheint bei etwa 175–200 nm für Alkohole, Ether und Amine und bewegt sich für Sulfide zu 200–220 nm.
- Aldehyde, Ketone, Säuren und Derivate. Die chromophore Gruppe dieser Verbindungen ist Carbonyl (C=O). Da Sauerstoff freie Elektronenpaare hat, ist der Übergang mit der niedrigsten Energie $n\rightarrow\pi^{\ast}$, aber es ist ein verbotener Übergang ($\epsilon_{max}=15$), da es keine Überlappung gibt die beteiligten Orbitale. Der nächstniedrigere Energieübergang ist $\pi\rightarrow\pi^{\ast}$, beobachtbar bei $\lambda_{max}=188\;nm$, mit einem molaren Absorptionsvermögen von 900.
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 22796
Konjugierte Systeme absorbieren bei längeren Wellenlängen als unkonjugierte. Mit zunehmender Konjugation nimmt die Energiedifferenz zwischen HOMO und LUMO ab und die zur Erzeugung des Übergangs $\pi \rightarrow \pi^{\ast}$ notwendige Strahlung verringert ihre Wellenlänge.
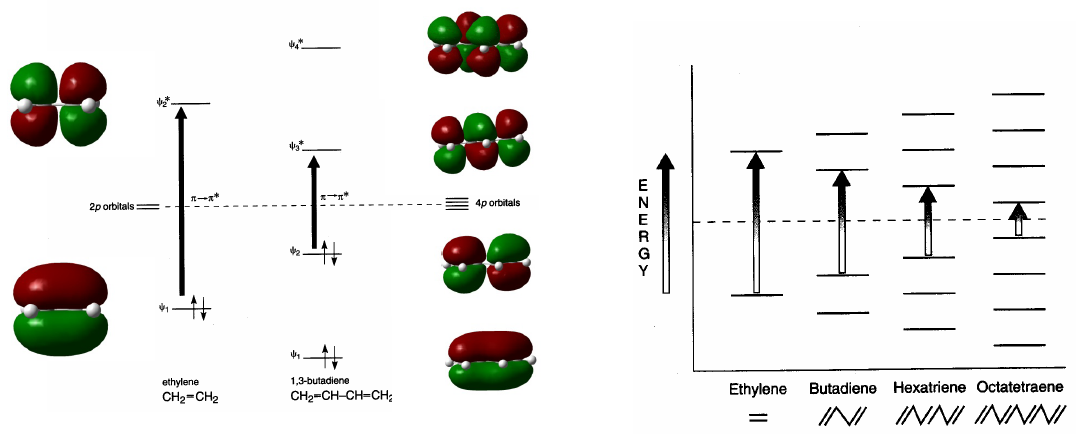
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 15610
Das Diagramm der α,β$-ungesättigten Molekülorbitale wird aus den Molekülorbitalen von Ethen und Carbonyl aufgebaut
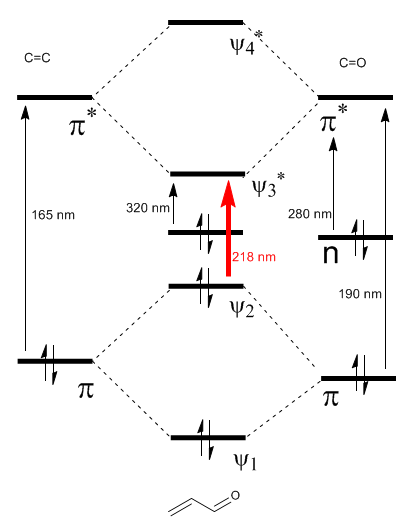
Weiterlesen: Bathochrome Wirkung auf $\alpha,\beta$-ungesättigte Carbonyle
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 15169
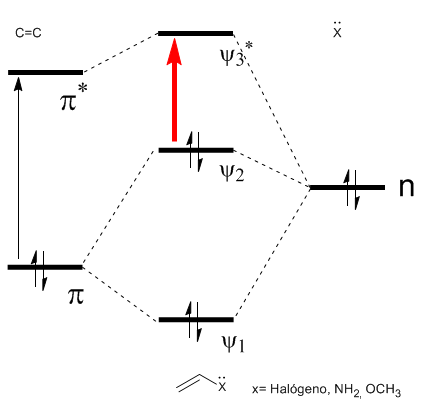
Wie im Diagramm zu sehen ist, erzeugt die Konjugation mit den freien Elektronenpaaren der Gruppe X eine Annäherung zwischen den HOMO- und LUMO-Orbitalen, was zu einem Übergang mit niedrigerer Energie (längerer Wellenlänge) als in Ethen führt.
- Details
- Germán Fernández
- ULTRAVIOLETT-SICHTBAR SPEKTROSKOPIE (UV-VIS)
- Zugriffe: 26954
Das Absorptionsspektrum von Benzol besteht aus drei Banden bei 184, 204 und 256 nm, die oft als $\alpha$, p und $\beta$ bezeichnet werden. Die Bänder $\alpha$, p werden auch als Primärband und das $\beta$-Sekundärband bezeichnet. Das Sekundärband ist aufgrund seiner Schwingungsstruktur breit.