Видимая ультрафиолетовая спектроскопия
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 84660
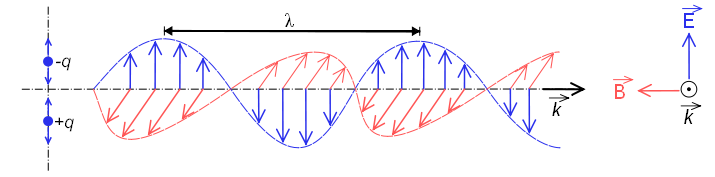
Спектроскопия изучает взаимодействие между электромагнитным излучением и веществом. При этом взаимодействии электромагнитное излучение может вести себя как волна или как частица, хотя не наблюдалось ни одного физического явления, при котором оба поведения проявлялись бы одновременно.
Когда он ведет себя как волна, он состоит из электрического поля и магнитного поля, которые колеблются перпендикулярно и распространяются со скоростью света $c=300000\;км/с$.
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 19279
Существуют три зоны электромагнитного спектра, представляющие особый интерес для определения химических соединений:
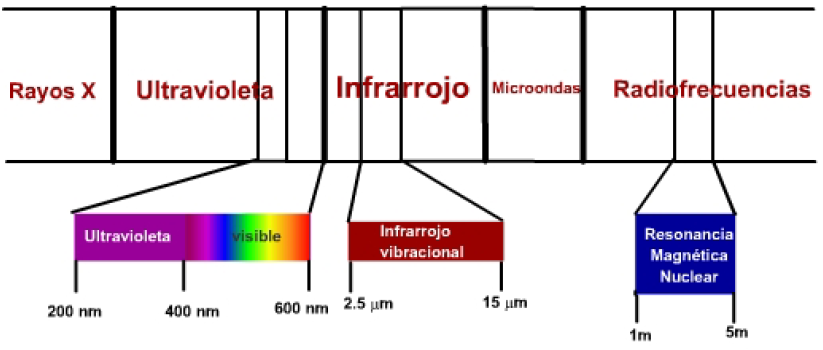
- Видимое ультрафиолетовое излучение имеет достаточную энергию для осуществления переходов молекулярных электронов на более высокие энергетические уровни. Это так называемая УФ-спектроскопия, полезность которой в основном ограничивается определением молекул с ненасыщенностью.
- Инфракрасное излучение вызывает переходы между колебательными уровнями молекулы. Связи между атомами молекулы не являются жесткими, а колеблются вокруг положения равновесия, и инфракрасное излучение способно перевести эти связи на более высокие уровни колебательной энергии. Это называется инфракрасной (ИК) спектроскопией.
- Радиоволны имеют достаточную энергию, чтобы заставить атомные ядра, находящиеся в магнитном поле, резонировать. Этот метод называется спектроскопией ядерного магнитного резонанса (ЯМР).
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 28027
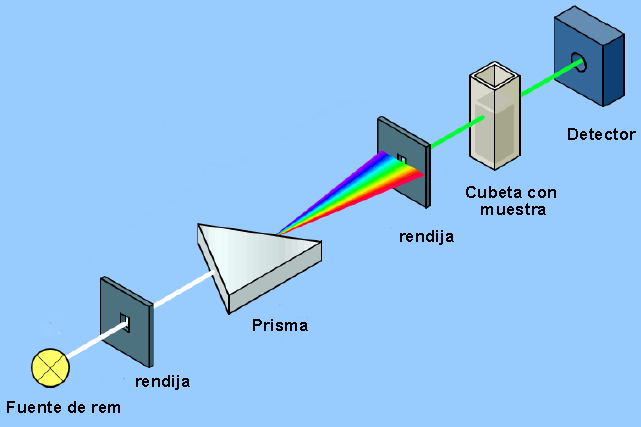
Прибор, который позволяет обнаруживать взаимодействие между электромагнитным излучением и веществом, называется спектрофотометром, и его базовую структуру можно увидеть на следующей схеме.
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 39163
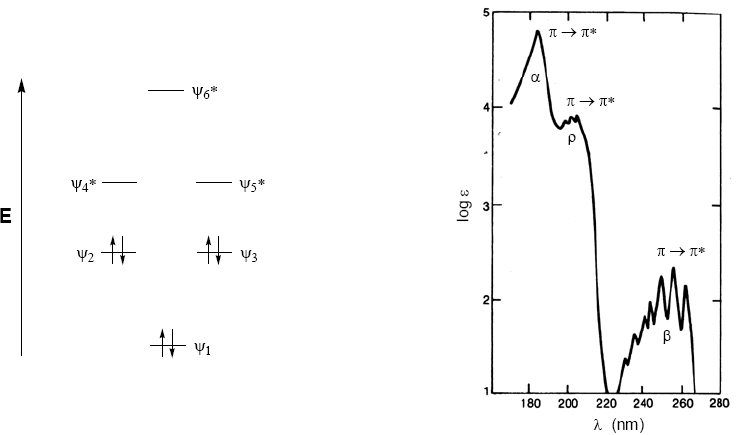
Органические молекулы распределяют свои электроны на разных электронных уровнях, называемых молекулярными орбиталями. Молекулярные орбитали с наименьшей энергией – это $\sigma$, за которыми следуют $\pi$-орбитали. При наличии в молекуле атомов со свободными электронными парами (кислород, сера, азот, галогены) мы будем иметь несвязывающие уровни n. Эти электронные уровни расположены в области связи диаграммы. В области разрыхления находятся молекулярные орбитали $\pi^{\ast}$ и $\sigma^{\ast}$. Молекула в основном состоянии имеет занятые связывающие и несвязывающие орбитали и незанятые разрыхляющие орбитали.
Из сказанного выше можно сделать вывод, что электронные переходы должны начинаться со связывающих и несвязывающих орбиталей и заканчиваться на разрыхляющих. Таким образом, мы можем иметь 5 типов электронных переходов, показанных на следующей диаграмме.
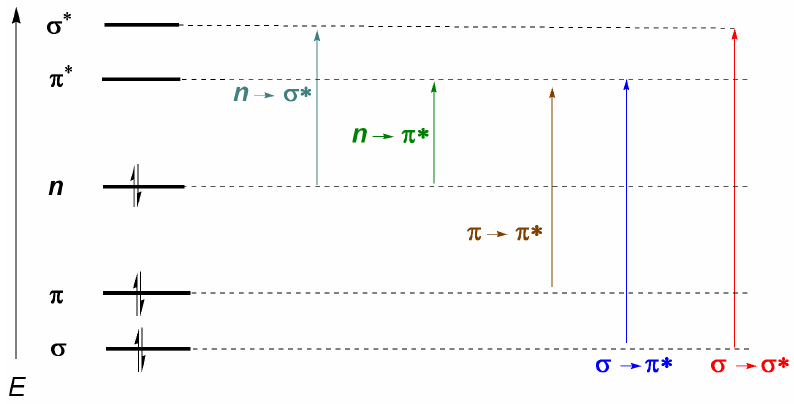
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 49240
Закон Ламберта-Бера вводит понятие оптической плотности (A) образца как $A=log\frac{I}{I_0}$. Где $I_0$ представляет собой интенсивность падающего света, а I — интенсивность света, проходящего через ячейку. Мы также можем выразить поглощение как функцию длины кюветы и концентрации растворенного вещества. \begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation} Где $l$ — длина кюветы в см, $c$ — концентрация растворенного вещества в моль/л, а $\epsilon$ – молярная абсорбционная способность (молярный коэффициент экстинкции), измеренная в л/моль·см.
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 23816
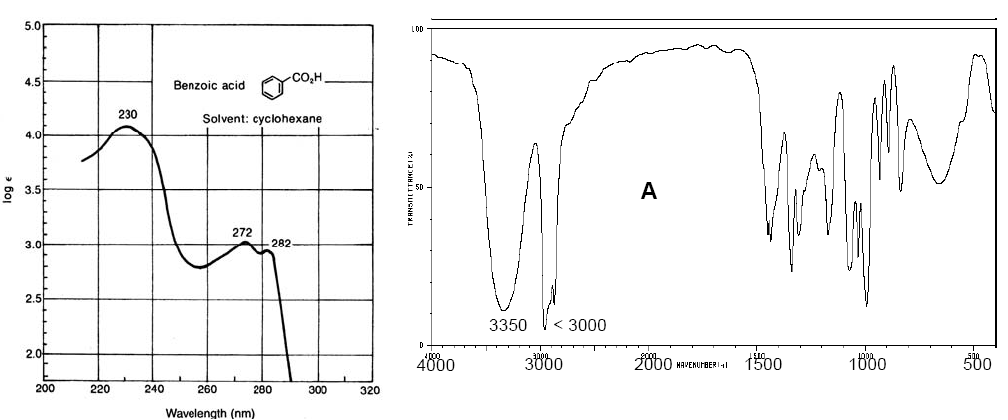 Видимый-УФ спектр бензойной кислоты (слева). ИК-спектр циклопентанола (справа)
Видимый-УФ спектр бензойной кислоты (слева). ИК-спектр циклопентанола (справа)
Спектры в видимой и ультрафиолетовой областях имеют более низкое разрешение, чем в ИК, поскольку каждый электронный уровень делится на колебательные уровни, а те, в свою очередь, на вращательные уровни, так что электронный переход состоит из большого набора вращательно-колебательных переходов. В ИК-спектрах также присутствуют полосы значительной амплитуды, обусловленные вращательными переходами, происходящими одновременно с колебательными переходами.
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 64457
Хромофорные группы — это функциональные группы молекулы, отвечающие за абсорбцию. В основном это: углерод-углеродные двойные и тройные связи, ароматические системы, карбонильная группа, имино (C=N), диазо (N=N), нитро и CY связи (Y - атом с неподеленными парами).
Ауксохромные группы являются заместителями на хромофоре и изменяют $\lambda_{max}$ и/или $\epsilon_{max}$. Метильная, галогенная, гидроксильная, алкокси- и аминогруппы являются ауксохромами.
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 33207
- Алканы. Его полосы поглощения обусловлены переходами $\sigma\rightarrow\sigma^{\ast}$ связей CC и CH. Эти переходы имеют высокую энергию и происходят на длинах волн ниже 150 нм, поэтому их невозможно наблюдать в обычных спектрофотометрах. Эта характеристика позволяет использовать их в качестве растворителей для анализируемого образца, поскольку они не мешают своим сигналам.
- Алкены и алкины. На них видны полосы поглощения, обусловленные переходами $\pi\rightarrow\pi^{\ast}$ тройной связи CC. Этот переход имеет меньшую энергию, чем в случае алканов, и проявляется при более длинных волнах (алкены: 175 нм; алкины: 170 нм). Двойная и тройная связи являются хромофорными группами этих молекул.
- Эфиры, тиолы, сульфиды, амины: В этом случае хромофорная группа образована гетероатомом (O,S,N) и атомами, которые его связывают. Гетероатом представляет собой неподеленные пары, а переход, вызывающий поглощение, равен $n\rightarrow\sigma^{\ast}$. Эта полоса поглощения появляется в районе 175–200 нм для спиртов, простых эфиров и аминов и достигает 200–220 нм для сульфидов.
- Альдегиды, кетоны, кислоты и производные. Хромофорной группой этих соединений является карбонильная (C=O). Поскольку у кислорода есть неподеленные пары, переход с наименьшей энергией $n\rightarrow\pi^{\ast}$, но это запрещенный переход ($\epsilon_{max}=15$), так как нет перекрытия между участвующих орбиталей. Следующим переходом с самой низкой энергией является переход $\pi\rightarrow\pi^{\ast}$, наблюдаемый при $\lambda_{max}=188\;nm$, с молярной поглощательной способностью 900.
Подробнее: Спектры видимого и ультрафиолетового излучения в органических соединениях
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 22952
Сопряженные системы поглощают на более длинных волнах, чем несопряженные. По мере увеличения сопряжения разница энергий между ВЗМО и НСМО уменьшается, а излучение, необходимое для осуществления перехода $\pi \rightarrow \pi^{\ast}$, уменьшает свою длину волны.
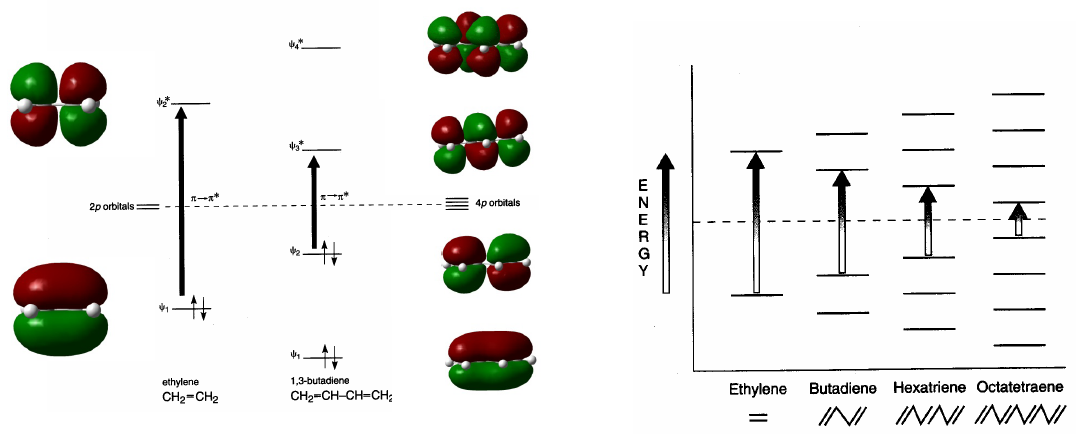
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 15641
Диаграмма \альфа,\бета$-ненасыщенных молекулярных орбиталей построена из молекулярных орбиталей этена и карбонила
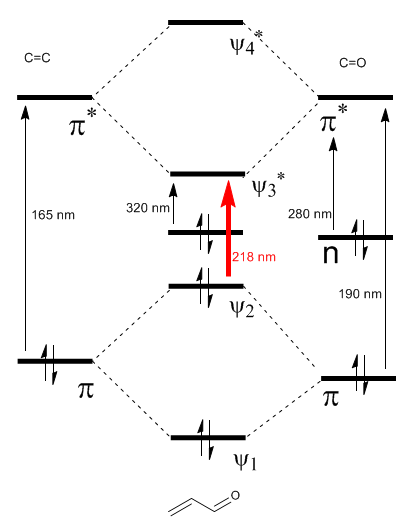
Подробнее: Батохромный эффект на $\alpha,\beta$-ненасыщенные карбонилы
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 14916
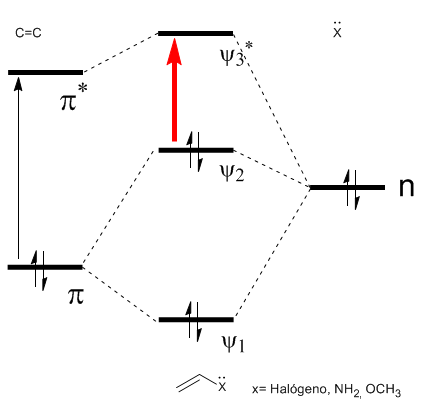
Как видно на диаграмме, сопряжение с неподеленными парами группы X приводит к сближению орбиталей ВЗМО и НСМО, что приводит к переходу с более низкой энергией (с большей длиной волны), чем в этилене.
- Информация о материале
- Germán Fernández
- Видимая ультрафиолетовая спектроскопия
- Просмотров: 25810
Спектр поглощения бензола состоит из трех полос при 184, 204 и 256 нм, часто называемых $\alpha$, p и $\beta$. Полосы $\alpha$, p также известны как первичная и вторичная полоса $\beta$. Вторичная полоса широкая из-за своей колебательной структуры.