Spettroscopia visibile-ultravioletto
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 84105
La spettroscopia studia l'interazione tra la radiazione elettromagnetica e la materia. In questa interazione, la radiazione elettromagnetica può comportarsi come un'onda o come una particella, sebbene non sia stato osservato alcun fenomeno fisico in cui entrambi i comportamenti si verifichino simultaneamente.
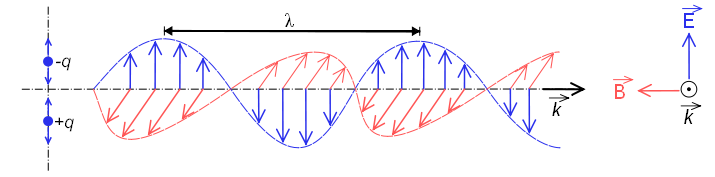
Quando si comporta come un'onda, è costituita da un campo elettrico e da un campo magnetico che oscillano perpendicolarmente e si propagano alla velocità della luce $c=300000\;km/s$
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 19388
Esistono tre zone dello spettro elettromagnetico di particolare interesse per la determinazione dei composti chimici:
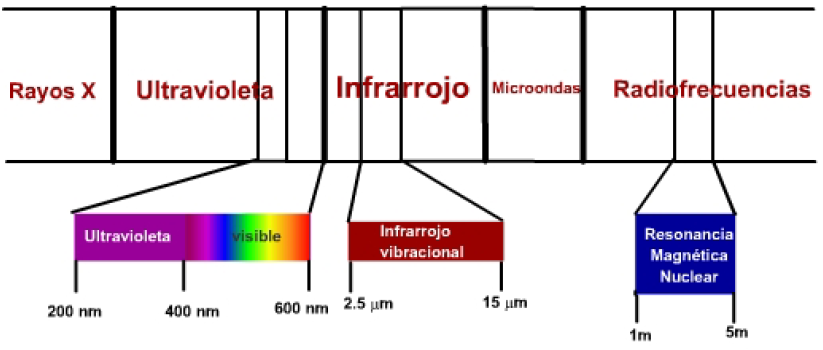
- La radiazione visibile-ultravioletta ha un'energia adeguata per produrre transizioni di elettroni molecolari a livelli di energia più elevati. È la cosiddetta spettroscopia UV, la cui utilità è principalmente limitata alla determinazione di molecole con insaturazioni.
- La radiazione infrarossa produce transizioni tra i livelli vibrazionali di una molecola. I legami tra gli atomi di una molecola non sono rigidi, ma vibrano attorno a una posizione di equilibrio e la radiazione infrarossa è in grado di portare questi legami a livelli di energia vibrazionale più elevati. Questa è chiamata spettroscopia a infrarossi (IR).
- Le onde radio hanno un'energia adeguata per far risuonare i nuclei atomici, sottoposti a un campo magnetico. Questa tecnica è chiamata spettroscopia di risonanza magnetica nucleare (NMR).
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 28564
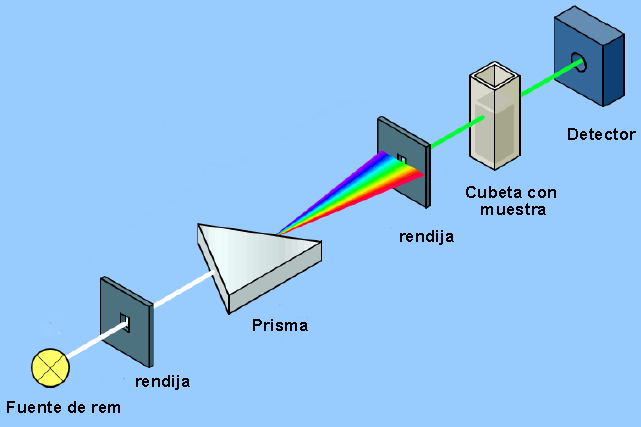
Lo strumento che permette di rilevare l'interazione tra radiazione elettromagnetica e materia è chiamato spettrofotometro e la sua struttura di base è visibile nel diagramma seguente.
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 39759
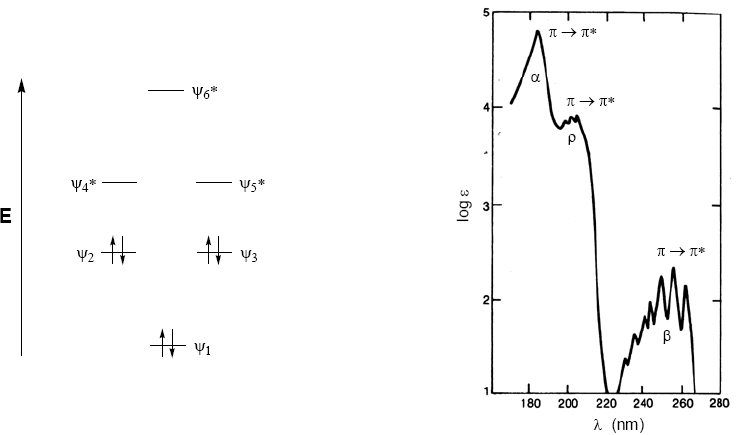
Le molecole organiche distribuiscono i loro elettroni in diversi livelli elettronici chiamati orbitali molecolari. Gli orbitali molecolari a più bassa energia sono $\sigma$, seguiti dagli orbitali $\pi$. Quando nella molecola sono presenti atomi con coppie elettroniche libere (ossigeno, zolfo, azoto, alogeni) avremo livelli di non legame n. Questi livelli elettronici sono disposti nella regione di legame del diagramma. Nella regione di antilegame troviamo gli orbitali molecolari $\pi^{\ast}$ e $\sigma^{\ast}$. Una molecola nel suo stato fondamentale ha orbitali di legame e non di legame occupati e orbitali di antilegame non occupati.
Da quanto discusso sopra, si può dedurre che le transizioni elettroniche devono iniziare dagli orbitali di legame e di non legame e terminare in quelli di antilegame. Così possiamo avere i 5 tipi di transizioni elettroniche mostrate nel diagramma seguente.
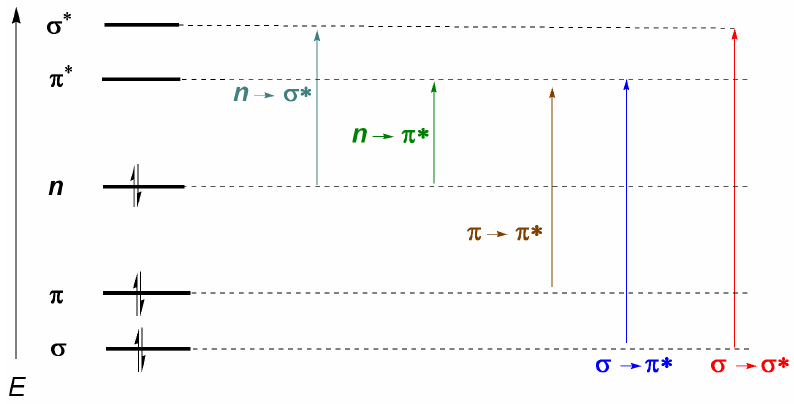
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 50149
La legge di Lambert-Beer introduce il concetto di assorbanza (A) di un campione come $A=log\frac{I}{I_0}$. Dove $I_0$ rappresenta l'intensità della luce incidente e I l'intensità della luce che attraversa la cella. Possiamo anche esprimere l'assorbanza in funzione della lunghezza della cuvetta e della concentrazione del soluto. \begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation} Dove $l$ è la lunghezza della cuvetta in cm, $c$ rappresenta la concentrazione di soluto in mol/l e $\epsilon$ è l'assorbimento molare (coefficiente di estinzione molare) misurato in l/mol.cm.
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 24145
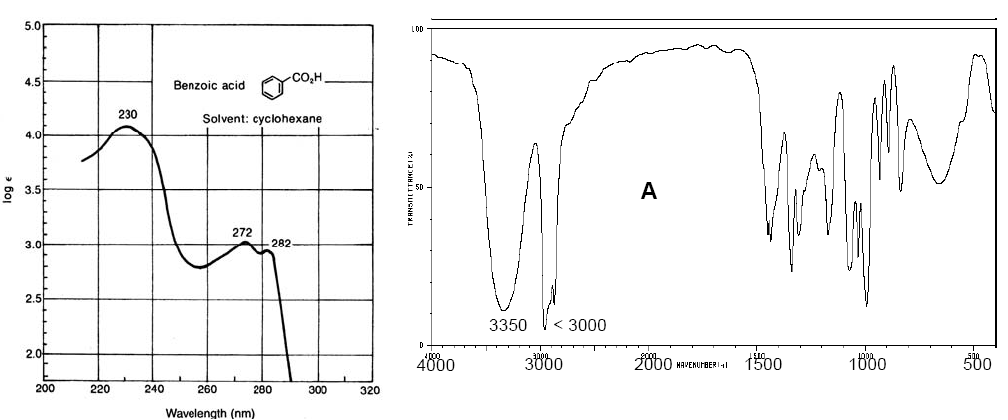 Spettro Vis-UV dell'acido benzoico (a sinistra). Spettro IR del ciclopentanolo (a destra)
Spettro Vis-UV dell'acido benzoico (a sinistra). Spettro IR del ciclopentanolo (a destra)
Gli spettri Vis-UV hanno una risoluzione inferiore rispetto all'IR perché ogni livello elettronico è suddiviso in livelli vibrazionali e questi a loro volta in livelli rotazionali, in modo tale che una transizione elettronica consiste in un ampio insieme di transizioni rotazionali-vibrazionali. . Gli spettri IR hanno anche bande di notevole ampiezza dovute alle transizioni rotazionali che si verificano contemporaneamente alle transizioni vibrazionali.
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 63832
I gruppi cromofori sono i gruppi funzionali della molecola responsabile dell'assorbimento. Principalmente sono: doppi e tripli legami carbonio-carbonio, sistemi aromatici, gruppo carbonile, legami immino (C=N), diazo (N=N), nitro e CY (Y è un atomo con coppie solitarie).
I gruppi auxocromici sono sostituenti sul cromoforo e alterano $\lambda_{max}$ e/o $\epsilon_{max}$. I gruppi metile, alogeno, idrossi, alcossi e ammino sono auxocromi.
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 33934
- Alcani. Le sue bande di assorbimento sono dovute alle transizioni $\sigma\rightarrow\sigma^{\ast}$ dei legami CC e CH. Queste transizioni sono di alta energia e avvengono a lunghezze d'onda inferiori a 150 nm, quindi non osservabili negli spettrofotometri convenzionali. Questa caratteristica consente di utilizzarli come solventi per il campione da analizzare, poiché non interferiscono con i loro segnali.
- Alcheni e alchini. Mostrano bande di assorbimento dovute alle transizioni $\pi\rightarrow\pi^{\ast}$ del triplo legame CC. Questa transizione è di energia inferiore rispetto al caso degli alcani e appare a lunghezze d'onda maggiori (alcheni: 175 nm; alchini: 170 nm). Il doppio e triplo legame sono i gruppi cromofori di queste molecole.
- Eteri, tioli, solfuri, ammine: in questo caso il gruppo cromoforo è formato dall'eteroatomo (O,S,N) e dagli atomi che lo legano. L'eteroatomo presenta coppie solitarie e la transizione che produce l'assorbimento è $n\rightarrow\sigma^{\ast}$. Questa banda di assorbimento appare intorno ai 175-200 nm per alcoli, eteri e ammine, spostandosi a 200-220 nm per i solfuri.
- Aldeidi, chetoni, acidi e derivati. Il gruppo cromoforo di questi composti è il carbonile (C=O). Poiché l'ossigeno ha coppie solitarie, la transizione con l'energia più bassa è $n\rightarrow\pi^{\ast}$, ma è una transizione proibita ($\epsilon_{max}=15$), poiché non c'è sovrapposizione tra gli orbitali coinvolti. La prossima transizione energetica più bassa è $\pi\rightarrow\pi^{\ast}$, osservabile a $\lambda_{max}=188\;nm$, con un'assorbenza molare di 900.
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 23164
I sistemi coniugati assorbono a lunghezze d'onda maggiori rispetto a quelli non coniugati. All'aumentare della coniugazione, la differenza di energia tra HOMO e LUMO diminuisce e la radiazione necessaria per produrre la transizione $\pi \rightarrow \pi^{\ast}$ diminuisce la sua lunghezza d'onda.
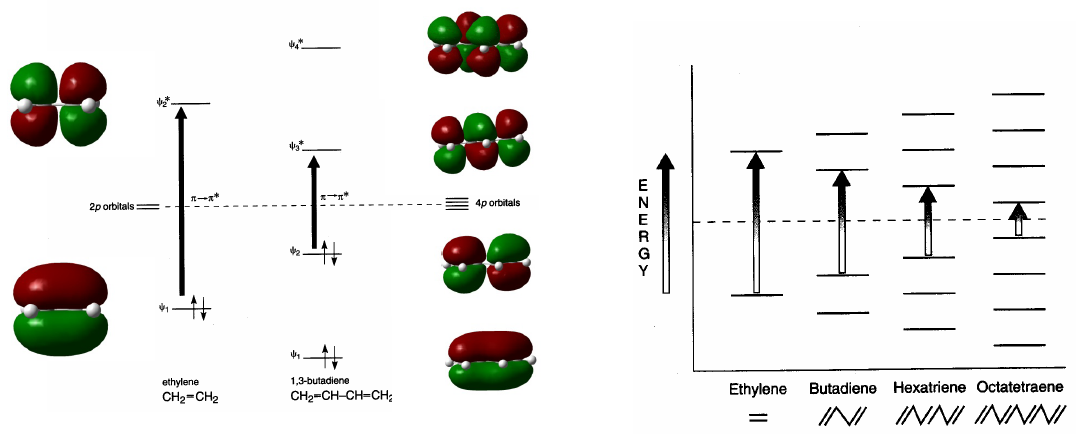
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 15891
Il diagramma degli orbitali molecolari \alpha,\beta$-insaturi è costruito dagli orbitali molecolari dell'etene e del carbonile
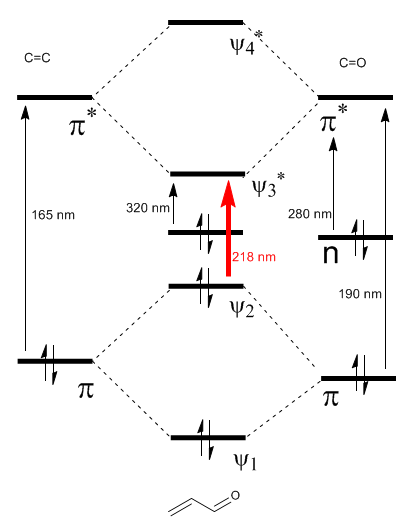
Leggi tutto: Effetto batocromico su $\alpha,\beta$-carbonili insaturi
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 15280
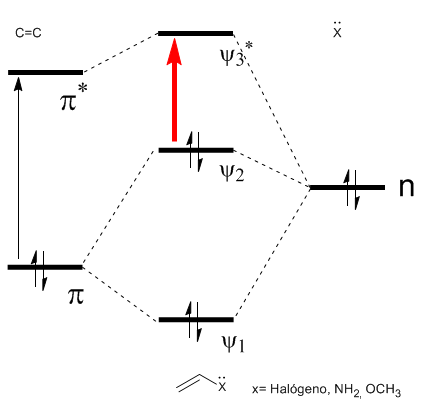
Come si può vedere nel diagramma, la coniugazione con le coppie solitarie del gruppo X produce un avvicinamento tra gli orbitali HOMO e LUMO, dando origine a una transizione di energia inferiore (lunghezza d'onda maggiore) rispetto all'etene.
- Dettagli
- Germán Fernández
- Spettroscopia visibile-ultravioletto
- Visite: 26196
Lo spettro di assorbimento del benzene consiste di tre bande a 184, 204 e 256 nm, spesso chiamate $\alpha$, p e $\beta$. Le bande $\alpha$, p sono anche conosciute come banda primaria e $\beta$ secondaria. La banda secondaria è ampia a causa della sua struttura vibrazionale.