Moléculas orgânicas distribuem seus elétrons em diferentes níveis eletrônicos chamados orbitais moleculares. Os orbitais moleculares de menor energia são $\sigma$, seguidos pelos orbitais $\pi$. Quando na molécula existem átomos com pares eletrônicos livres (oxigênio, enxofre, nitrogênio, halogênios) teremos níveis de não ligação n. Esses níveis eletrônicos estão dispostos na região de ligação do diagrama. Na região antiligante encontramos os orbitais moleculares $\pi^{\ast}$ e $\sigma^{\ast}$. Uma molécula em seu estado fundamental tem orbitais ligantes e não ligantes ocupados e orbitais antiligantes desocupados.
Do que foi discutido acima, pode-se deduzir que as transições eletrônicas devem começar nos orbitais ligantes e não ligantes terminando nos antiligantes. Assim podemos ter os 5 tipos de transições eletrônicas mostradas no diagrama a seguir.
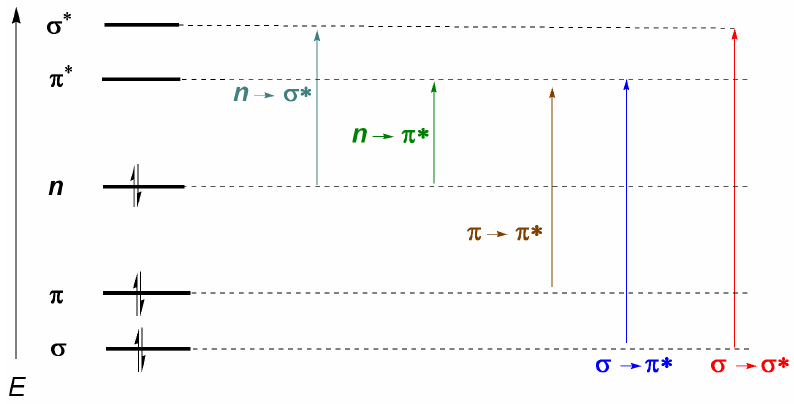
A transição eletrônica mais importante é geralmente do HOMO (último orbital ocupado) para o LUMO (primeiro orbital vazio) que corresponde ao menor salto energético e corresponde a um longo comprimento de onda.
Em alcanos somente transições $\sigma \rightarrow \sigma^{\ast}$ são possíveis (etano: $\lambda =135\;nm$). Essas bandas não podem ser observadas com espectrofotômetros comerciais, pois eles varrem a partir de 200 nm. Entretanto, moléculas que apresentam ligações duplas conjugadas apresentam transições $\pi \rightarrow \pi^{\ast}$ que podem ser observadas (butadieno: $\lambda =217\;nm$).
Quando há átomos com pares solitários na molécula, a transição com menor energia (maior comprimento de onda) é $n\rightarrow \pi$. No entanto, é uma transição improvável, pois não há sobreposição entre os dois orbitais, causando bandas muito fracas. A partir deste último comentário segue a regra de seleção para espectroscopia UV-visível: $n\rightarrow \pi^{\ast}$ transições são "proibidas". Uma transição de baixa probabilidade é entendida como proibida.