TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 56168
Gli amminoacidi sono composti organici che contengono acido carbossilico e funzioni amminiche. Due amminoacidi possono essere uniti in opportune condizioni, attraverso un legame ammidico, formando un dipeptide. Il dipeptide può incorporare un terzo amminoacido, formando un tripeptide. Le catene con più di 50 amminoacidi sono chiamate proteine.
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 185268
I 20 amminoacidi che compongono le proteine sono: Serina (Ser,S), Treonina (Thr,T), Cisteina (Cys,C), Asparagina (Asn,N), Glutammina (Gln,Q) e Tirosina (Tyr , Y), Glicina (Gly,G), Alanina (Ala,A), Valina (Val,V), Leucina (Leu,L), Isoleucina (Ile,I), Metionina (Met,M), Prolina (Pro, P ), fenilalanina (Phe,F) e triptofano (Trp,W), acido aspartico (Asp,D) e acido glutammico (Glu,E), lisina (Lys,K), arginina (Arg,R) e istidina (His , h)
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 145004
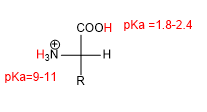 La presenza di gruppi acido (-COOH) e basico (-NH2) conferisce agli amminoacidi caratteristiche acido-base.
La presenza di gruppi acido (-COOH) e basico (-NH2) conferisce agli amminoacidi caratteristiche acido-base.
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 55714
Gli amminoacidi possono essere ottenuti mediante alogenazione di acidi carbossilici, seguita da sostituzione nucleofila con ammoniaca. L'alogenazione della posizione a dell'acido carbossilico viene effettuata con la reazione di Hell-Volhard-Zelinsky.
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 46217
In questa sintesi, il sale ftalimmide viene fatto reagire con l'estere malonico alogenato. Nelle fasi successive viene alchilato, idrolizzato e decarbossilato, ottenendo l'amminoacido.
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 32780
Questo è un metodo ampiamente utilizzato per la preparazione di amminoacidi in laboratorio. L'ammidato di etanammide viene fatto reagire con l'estere di malonio alogenato , ottenendo il composto che viene alchilato e idrolizzato per dare un diacido , che decarbossila per formare l'amminoacido .
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 55613
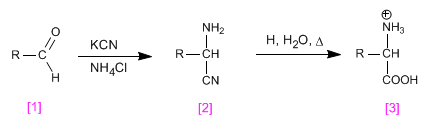
La sintesi di Strecker consente di ottenere amminoacidi da aldeidi o chetoni.
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 30821
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 30571
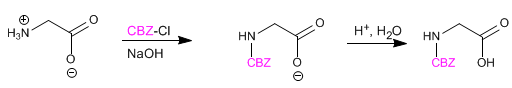
Il gruppo amminico è protetto per impedire la sua reazione con il gruppo acido del secondo amminoacido. Una volta formato il legame peptidico, viene eseguita la deprotezione, lasciando nuovamente libero il gruppo amminico.
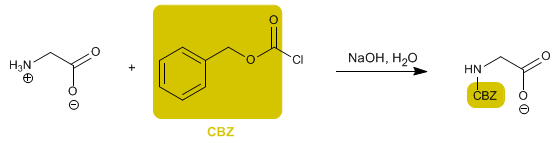
Leggi tutto: Sintesi di peptidi - Protezione del gruppo amminico
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 22850
Il gruppo acido viene protetto trasformandolo in un estere per reazione con un alcol. Gli esteri metilici, etilici o terz-butilici vengono preparati mediante esterificazione e idrolizzati (deprotetti) in un mezzo basico.
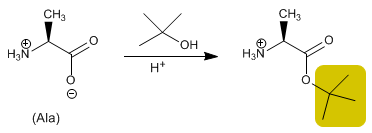
Leggi tutto: Sintesi peptidica - Protezione del gruppo acido
- Dettagli
- Germán Fernández
- TEORIA DEGLI AMINOACIDI E DEI PEPTIDI
- Visite: 49005
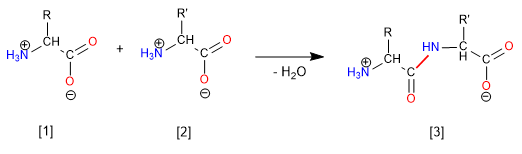
La sintesi del dipeptide Glicina-Alanina (Gly-Ala) avviene attraverso la formazione del legame ammidico (peptidico) tra il gruppo acido della Glicina e il gruppo amminico dell'alanina. Pertanto, è necessario proteggere il gruppo amminico della glicina e l'acido dell'alanina.