THEORIE DER AMINOSÄUREN UND PEPTIDE
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 56284
Aminosäuren sind organische Verbindungen, die Carbonsäure- und Aminofunktionen enthalten. Zwei Aminosäuren können unter geeigneten Bedingungen über eine Amidbindung zu einem Dipeptid verbunden werden. Das Dipeptid kann eine dritte Aminosäure enthalten, wodurch ein Tripeptid gebildet wird. Ketten mit mehr als 50 Aminosäuren nennt man Proteine.
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 187724
Die 20 Aminosäuren, aus denen Proteine bestehen, sind: Serin (Ser,S), Threonin (Thr,T), Cystein (Cys,C), Asparagin (Asn,N), Glutamin (Gln,Q) und Tyrosin (Tyr , Y), Glycin (Gly,G), Alanin (Ala,A), Valin (Val,V), Leucin (Leu,L), Isoleucin (Ile,I), Methionin (Met,M), Prolin (Pro, P), Phenylalanin (Phe,F) und Tryptophan (Trp,W), Asparaginsäure (Asp,D) und Glutaminsäure (Glu,E), Lysin (Lys,K), Arginin (Arg,R) und Histidin (His , h)
Weiterlesen: Die 20 Aminosäuren, aus denen Proteine bestehen
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 145693
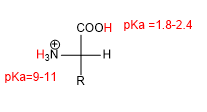 Das Vorhandensein von sauren (-COOH) und basischen (-NH 2 ) Gruppen verleiht Aminosäuren charakteristische Säure-Base-Eigenschaften.
Das Vorhandensein von sauren (-COOH) und basischen (-NH 2 ) Gruppen verleiht Aminosäuren charakteristische Säure-Base-Eigenschaften.
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 55899
Aminosäuren können durch Halogenierung von Carbonsäuren, gefolgt von nukleophiler Substitution mit Ammoniak, erhalten werden. Die Halogenierung der a-Stellung der Carbonsäure erfolgt mit der Hell-Volhard-Zelinsky-Reaktion.
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 45978
Bei dieser Synthese wird das Phthalimidsalz mit dem halogenierten Malonsäureester umgesetzt. In späteren Stadien wird es alkyliert, hydrolysiert und decarboxyliert, wodurch die Aminosäure erhalten wird.
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 32280
Dies ist eine weit verbreitete Methode zur Herstellung von Aminosäuren im Labor. Ethanamidamidat [1] wird mit dem halogenierten Malonsäureester [2] umgesetzt, wodurch die Verbindung [3] erhalten wird, die alkyliert und hydrolysiert wird, was eine Disäure [6] ergibt, die decarboxyliert, um die Aminosäure [7] zu bilden.
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 53537
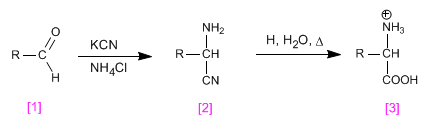
Die Strecker-Synthese ermöglicht die Gewinnung von Aminosäuren aus Aldehyden oder Ketonen.
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 30032
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 29770
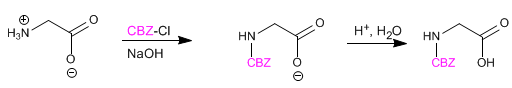
Die Aminogruppe ist geschützt, um ihre Reaktion mit der Säuregruppe der zweiten Aminosäure zu verhindern. Sobald die Peptidbindung gebildet ist, wird die Schutzgruppe entfernt, wodurch die Aminogruppe wieder frei bleibt.
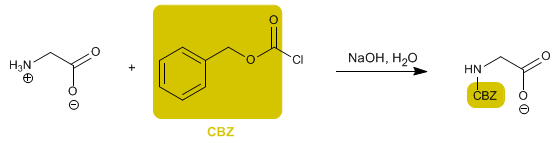
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 22511
Die Säuregruppe wird geschützt, indem sie durch Reaktion mit einem Alkohol in einen Ester umgewandelt wird. Methyl-, Ethyl- oder tert -Butylester werden durch Veresterung hergestellt und in basischem Medium hydrolysiert (entschützt).
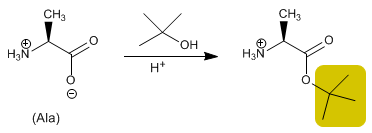
- Details
- Germán Fernández
- THEORIE DER AMINOSÄUREN UND PEPTIDE
- Zugriffe: 48273
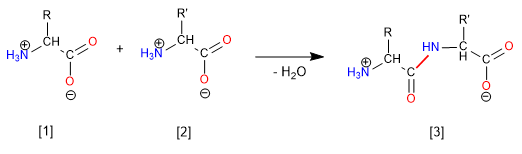
Die Synthese des Dipeptids Glycin-Alanin (Gly-Ala) erfolgt durch die Bildung der Amid-(Peptid-)Bindung zwischen der Säuregruppe von Glycin und der Aminogruppe von Alanin. Daher ist es notwendig, die Aminogruppe von Glycin und die Säure von Alanin zu schützen.