ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 56297
Аминокислоты представляют собой органические соединения, содержащие карбоксильную и аминогруппы. Две аминокислоты могут быть соединены при подходящих условиях через амидную связь, образуя дипептид. Дипептид может включать третью аминокислоту, образуя трипептид. Цепи, содержащие более 50 аминокислот, называются белками.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 212096
20 аминокислот, из которых состоят белки: серин (Ser, S), треонин (Thr, T), цистеин (Cys, C), аспарагин (Asn, N), глютамин (Gln, Q) и тирозин (Tyr). , Y), глицин (Gly,G), аланин (Ala,A), валин (Val,V), лейцин (Leu,L), изолейцин (Ile,I), метионин (Met,M), пролин (Pro, P), фенилаланин (Phe,F) и триптофан (Trp,W), аспарагиновая кислота (Asp,D) и глутаминовая кислота (Glu,E), лизин (Lys,K), аргинин (Arg,R) и гистидин (His). , ч)
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 150393
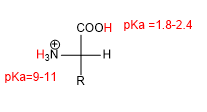 Наличие кислотной (-COOH) и основной (-NH 2 ) групп придает аминокислотам характерные кислотно-основные свойства.
Наличие кислотной (-COOH) и основной (-NH 2 ) групп придает аминокислотам характерные кислотно-основные свойства.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 55367
Аминокислоты могут быть получены путем галогенирования карбоновых кислот с последующим нуклеофильным замещением аммиаком. Галогенирование а-положения карбоновой кислоты проводят по реакции Хелла-Фольгарда-Зелинского.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 45667
В этом синтезе фталимидная соль взаимодействует с галогенированным эфиром малоновой кислоты. На более поздних стадиях его алкилируют, гидролизуют и декарбоксилируют, получая аминокислоту.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 32387
Это широко используемый метод получения аминокислот в лаборатории. Амидат этанамида [1] реагирует с галогенированным эфиром малоновой кислоты [2] с получением соединения [3] , которое алкилируется и гидролизуется с получением двухосновной кислоты [6] , которая декарбоксилируется с образованием аминокислоты [7] .
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 53065
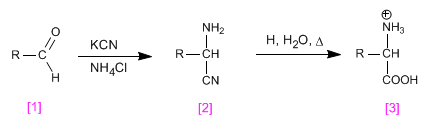
Синтез Штрекера позволяет получать аминокислоты из альдегидов или кетонов.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 30269
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 30100
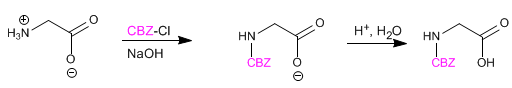
Аминогруппа защищена, чтобы предотвратить ее реакцию с кислотной группой второй аминокислоты. Как только пептидная связь образована, снимается защита, снова оставляя аминогруппу свободной.
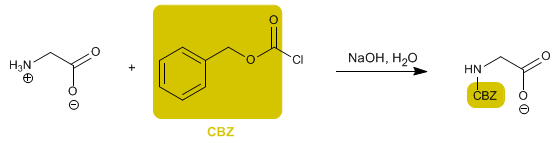
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 22707
Кислотную группу защищают, превращая ее в сложный эфир в результате реакции со спиртом. Метиловый, этиловый или трет -бутиловый эфир получают путем этерификации и гидролиза (снятия защиты) в щелочной среде.
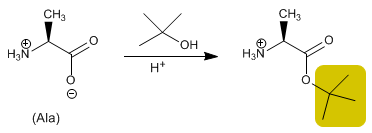
- Информация о материале
- Germán Fernández
- ТЕОРИЯ АМИНОКИСЛОТ И ПЕПТИДОВ
- Просмотров: 49048
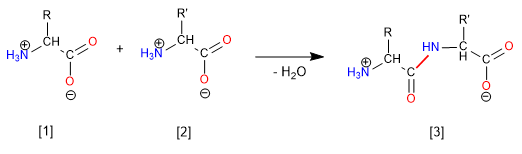
Синтез дипептида Глицин-Аланин (Гли-Ала) происходит за счет образования амидной (пептидной) связи между кислотной группой глицина и аминогруппой аланина. Поэтому необходимо защищать аминогруппу глицина и кислоту аланина.