TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 56523
Os aminoácidos são compostos orgânicos que contêm ácido carboxílico e funções amino. Dois aminoácidos podem ser unidos em condições adequadas, através de uma ligação amida, formando um dipeptídeo. O dipeptídeo pode incorporar um terceiro aminoácido, formando um tripeptídeo. Cadeias com mais de 50 aminoácidos são chamadas de proteínas.
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 187179
Os 20 aminoácidos que compõem as proteínas são: Serina (Ser,S), Treonina (Thr,T), Cisteína (Cys,C), Asparagina (Asn,N), Glutamina (Gln,Q) e Tirosina (Tyr , Y), Glicina (Gly,G), Alanina (Ala,A), Valina (Val,V), Leucina (Leu,L), Isoleucina (Ile,I), Metionina (Met,M), Prolina (Pro, P ), Fenilalanina (Phe,F) e Triptofano (Trp,W), Ácido Aspártico (Asp,D) e Ácido Glutâmico (Glu,E), Lisina (Lys,K), Arginina (Arg,R) e Histidina (His , h)
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 147713
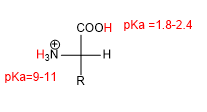 A presença de grupos ácido (-COOH) e básico (-NH 2 ) confere aos aminoácidos propriedades ácido-base características.
A presença de grupos ácido (-COOH) e básico (-NH 2 ) confere aos aminoácidos propriedades ácido-base características.
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 55370
Os aminoácidos podem ser obtidos por halogenação de ácidos carboxílicos, seguida de substituição nucleofílica por amônia. A halogenação da posição a do ácido carboxílico é realizada com a reação de Hell-Volhard-Zelinsky.
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 45488
Nesta síntese, o sal de ftalimida é reagido com o éster malônico halogenado. Em fases posteriores é alquilado, hidrolisado e descarboxilado, obtendo-se o aminoácido.
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 32477
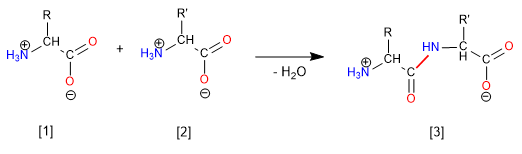
Este é um método amplamente utilizado para a preparação de aminoácidos em laboratório. O amidato de etanamida [1] é feito reagir com o éster malônico halogenado [2] , obtendo-se o composto [3] que é alquilado e hidrolisado dando um diácido [6] , que descarboxila para formar o aminoácido [7] .
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 53974
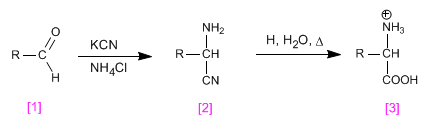
A síntese de Strecker permite a obtenção de aminoácidos a partir de aldeídos ou cetonas.
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 30127
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 29773
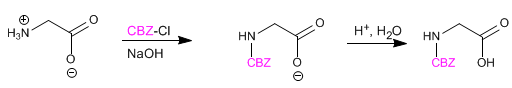
O grupo amino é protegido para evitar sua reação com o grupo ácido do segundo aminoácido. Uma vez que a ligação peptídica é formada, a desproteção é realizada, novamente deixando o grupo amino livre.
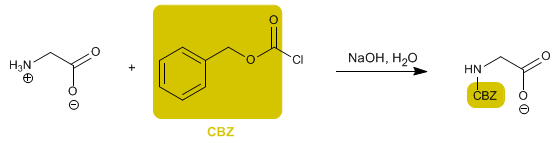
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 22409
O grupo ácido é protegido pela transformação em um éster pela reação com um álcool. Ésteres metílicos, etílicos ou terc -butílicos são preparados por esterificação e hidrolisados (desprotegidos) em meio básico.
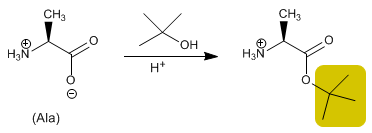
- Detalhes
- Germán Fernández
- TEORIA DOS AMINOÁCIDOS E PEPTÍDEOS
- Acessos: 47289
A síntese do dipeptídeo Glicina-Alanina (Gly-Ala) ocorre através da formação da ligação amida (peptídeo) entre o grupo ácido da Glicina e o grupo amino da alanina. Portanto, é necessário proteger o grupo amino da glicina e o ácido da alanina.