STEREOCHIMICA II
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 2599
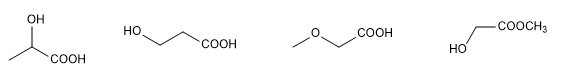
La determinazione della struttura di una molecola organica inizia con l'analisi degli elementi in essa contenuti e della loro proporzione, che solitamente viene effettuata mediante combustione. La determinazione della massa molecolare, precedentemente eseguita mediante discesa crioscopica, utilizza ora la tecnica della spettrometria di massa ad alta risoluzione.
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 2732
Le diverse disposizioni spaziali che una molecola può assumere e che vengono interconvertite a temperatura ambiente per rotazione sono chiamate conformazioni.
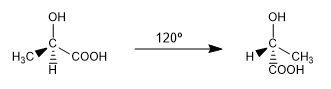
Sono due delle infinite conformazioni che si possono trarre dall'ac. 2-idrossipropanoico. A temperatura ambiente la molecola ruota continuamente attraverso tutte le possibili conformazioni.
Ora diamo un'occhiata alle due conformazioni più caratteristiche dell'etano, le conformazioni alternate ed eclissate.
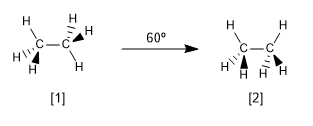
[1] Conformazione alternata dell'etano
[2] Conformazione eclissata dell'etano
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 2827
Una molecola chirale è una molecola che non è sovrapponibile alla sua immagine speculare. La simmetria fa sì che le molecole perdano la loro chiralità. Pertanto, la presenza di piani di simmetria, centri di inversione o assi alternati danno origine a molecole achirali.
a) Asse di simmetria (C n )
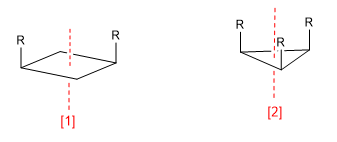
[1] Asse di simmetria (C2 )
[2] Asse di simmetria (C3 )
Un asse di simmetria di ordine m lascia la molecola in una configurazione indistinguibile da quella iniziale quando ruota di 360/m gradi.
b) Piano di riflessione ( s ): Divide la molecola in due parti uguali. Ogni atomo della molecola che si trova su un lato del piano deve avere il suo specchio sull'altro lato.
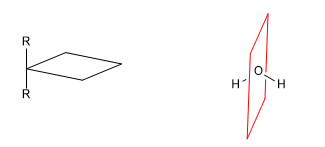
Leggi tutto: Elementi di simmetria che portano a molecole achirali
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 2944
Chiralità è sinonimo di asimmetria, gli oggetti chirali sono caratterizzati dall'assenza di simmetria, guardate le lancette.
Leggi tutto: Elementi di asimmetria che portano a molecole chirali
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 3054
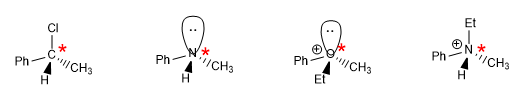
Le regole per dare configurazione assoluta ad un centro stereogenico sono le seguenti:
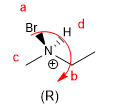
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 2611
Nelle molecole il cui elemento di chiralità è un asse, daremo la notazione R a / S a , (il pedice "a" si riferisce ad assiale), mediante il metodo della proiezione di Fischer. Si può usare anche il metodo del tetraedro.
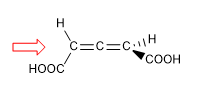
1. Affinché la molecola abbia un asse di chiralità, è necessario che i due gruppi su ciascun lato siano diversi tra loro. In questo esempio i gruppi sono diversi (-H e -COOH) e la molecola ha un asse di chiralità.
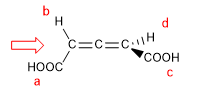
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 2398
Si tratta di molecole che hanno un'area piatta (fenile), con un ponte che unisce le loro estremità sulla faccia superiore o inferiore.
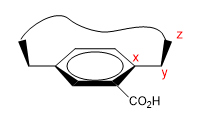
1. Assegniamo nomi a determinati atomi come mostrato nell'immagine. "z" è il primo atomo fuori piano. Da x partono due catene, alle quali dobbiamo dare priorità per numero atomico.
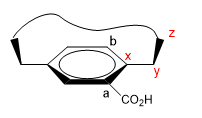
2. Proiettiamo il collegamento xy, ponendoci nella posizione della freccia.
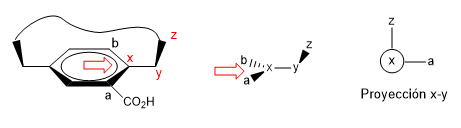
- Dettagli
- Germán Fernández
- STEREOCHIMICA II
- Visite: 2583
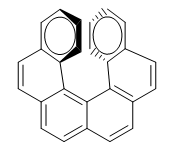
La repulsione tra gli anelli impedisce alla molecola di disporsi nel piano. Quindi uno degli anelli si piega verso di noi e l'altro in basso. In un enantiomero l'anello a destra è piegato verso di noi e nell'altro verso il basso.
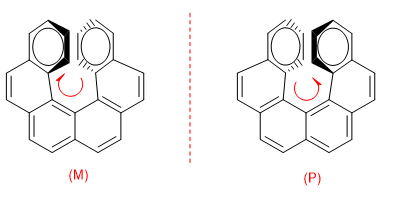
Per distinguere entrambi gli enantiomeri si compie un giro dall'anello che va verso il basso a quello che ci viene incontro: se questo giro è in senso orario l'enantiomero è M, se il giro è in senso opposto l'enantiomero è P.