THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 56466
Les acides aminés sont des composés organiques qui contiennent des fonctions acide carboxylique et amino. Deux acides aminés peuvent être joints dans des conditions appropriées, par une liaison amide, formant un dipeptide. Le dipeptide peut incorporer un troisième acide aminé, formant un tripeptide. Les chaînes de plus de 50 acides aminés sont appelées protéines.
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 186521
Les 20 acides aminés qui composent les protéines sont : la sérine (Ser,S), la thréonine (Thr,T), la cystéine (Cys,C), l'asparagine (Asn,N), la glutamine (Gln,Q) et la tyrosine (Tyr , Y), Glycine (Gly,G), Alanine (Ala,A), Valine (Val,V), Leucine (Leu,L), Isoleucine (Ile,I), Méthionine (Met,M), Proline (Pro, P ), phénylalanine (Phe,F) et tryptophane (Trp,W), acide aspartique (Asp,D) et acide glutamique (Glu,E), lysine (Lys,K), arginine (Arg,R) et histidine (His , h)
Lire la suite : Les 20 acides aminés qui composent les protéines
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 148977
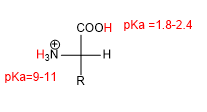 La présence de groupements acides (-COOH) et basiques (-NH 2 ) confère aux acides aminés des propriétés acido-basiques caractéristiques.
La présence de groupements acides (-COOH) et basiques (-NH 2 ) confère aux acides aminés des propriétés acido-basiques caractéristiques.
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 55763
Les acides aminés peuvent être obtenus par halogénation d'acides carboxyliques, suivie d'une substitution nucléophile avec de l'ammoniac. L'halogénation de la position a de l'acide carboxylique est réalisée par la réaction Hell-Volhard-Zelinsky.
Lire la suite : Synthèse des acides aminés - Hell-Volhard-Zelinsky
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 46208
Dans cette synthèse, le sel de phtalimide est mis à réagir avec l'ester malonique halogéné. Dans les étapes ultérieures, il est alkylé, hydrolysé et décarboxylé, obtenant l'acide aminé.
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 32780
Il s'agit d'une méthode largement utilisée pour la préparation d'acides aminés en laboratoire. L'amidate d'éthanamide [1] est mis à réagir avec l'ester malonique halogéné [2] , obtenant le composé [3] qui est alkylé et hydrolysé donnant un diacide [6] , qui se décarboxyle pour former l'acide aminé [7] .
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 54800
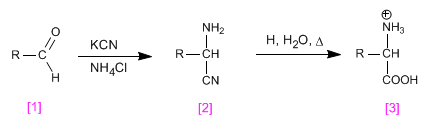
La synthèse Strecker permet d'obtenir des acides aminés à partir d'aldéhydes ou de cétones.
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 30319
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 30532
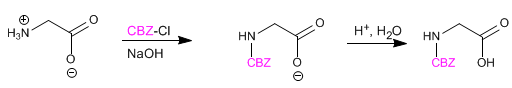
Le groupe amino est protégé pour empêcher sa réaction avec le groupe acide du deuxième acide aminé. Une fois la liaison peptidique formée, une déprotection est effectuée, laissant à nouveau le groupe amino libre.
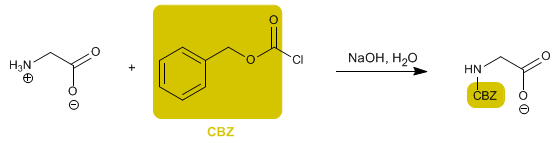
Lire la suite : Synthèse peptidique - Protection du groupe amino
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 23660
Le groupement acide est protégé en le transformant en ester par réaction avec un alcool. Les esters méthyliques, éthyliques ou tert -butyliques sont préparés par estérification et hydrolysés (déprotégés) en milieu basique.
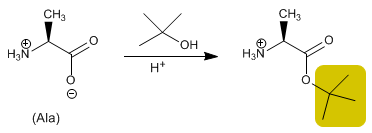
Lire la suite : Synthèse peptidique - Protection des groupes acides
- Détails
- Germán Fernández
- THÉORIE DES ACIDES AMINÉS ET DES PEPTIDES
- Affichages : 47934
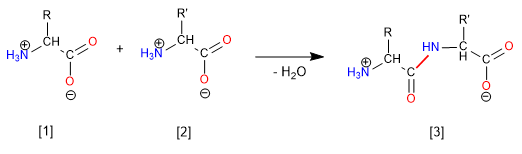
La synthèse du dipeptide Glycine-Alanine (Gly-Ala) se fait par la formation de la liaison amide (peptide) entre le groupe acide de la Glycine et le groupe amino de l'alanine. Par conséquent, il est nécessaire de protéger le groupe amino de la glycine et l'acide de l'alanine.