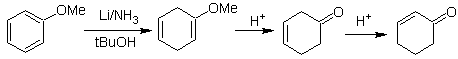Formation d'énols et d'énolates
Le carbone alpha des composés contenant le groupe carbonyle (aldéhydes, cétones, esters, dicétones, diesters, nitrates, nitriles, etc.), est au centre de nombreuses réactions de formation de liaisons CC. En raison de l'acidité des H a , ils subissent une -déprotonation en présence d'une base appropriée, avec pour conséquence la formation d'un carbanion. La charge négative résultante sur C a à C = O est stabilisée en résonance par le même groupe carbonyle.
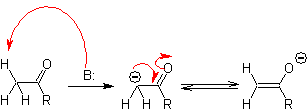
La sélection de la base, pour la formation d'énolates, est soumise au fait que le pKa de l'acide conjugué de la base doit être supérieur d'au moins trois unités au pKa du composé carbonylé qui a des H acides .
|
|
pKa = 20 |
MeO- pKa = 15 |
Formation d'énolate défavorable |
|
|
pKa = 10 |
tBuO- _ pKa = 19 |
Formation d'énolates très favorable |
Formation d'énolates :
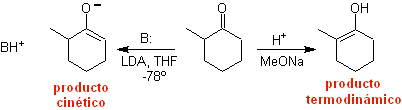
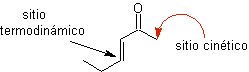
¨ L'énolate cinétique
|
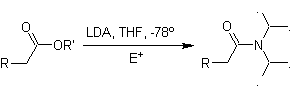
Cela se produit parce que le substrat a H α , facilement accessible pour la déprotonation à travers une base typique telle que LDA (pKa environ 30) Le LDA (diisopropylamide de lithium) est une base forte, non nucléophile et à encombrement stérique. |
|
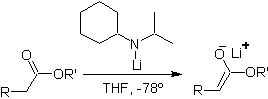
¨ Enolates d'esters :
Les esters sont susceptibles d'une réaction de substitution pour la base, LDA peut être problématique, c'est pourquoi la base non nucléophile (lithium isopropylcyclohexyl amide) est utilisée avec des esters.
¨ Énolate thermodynamique :
Une déprotonation réversible peut conduire à des énolates plus stables, ce qui se produit lorsque le C = C plus substitué de la forme énol est obtenu.
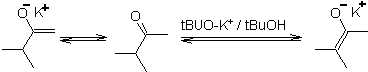
Les conditions typiques pour former des énolates thermodynamiques sont : RO-M+ dans ROH comme solvant protique (pKa de ROH = 15 à 18).
Les énolates cinétiques et thermodynamiques peuvent être piégés, isolés, séparés et purifiés pour obtenir des énolates régiochimiquement purs. Ceci peut être accompli par la formation d'acétates d'éther d'énol et de silylène.
¨ Acétate d'énol :
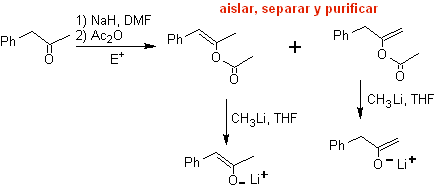
¨ Éther de silylène :
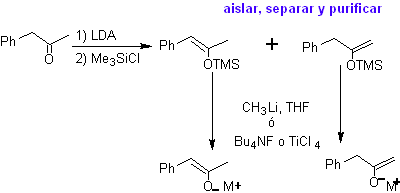
¨ Énolates à partir d'énones :
L'énolate est généré par réduction à partir de la dissolution d'un métal dans l'ammoniac liquide.
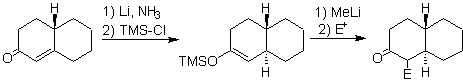
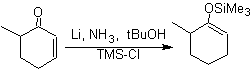
¨ Énolates de l'addition conjuguée (1,4) dans a , b - composés cétoniques insaturés
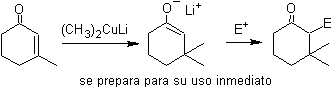
¨ Enolates issus de la réduction des a -halocarbonyles
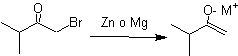
¨ Énolates de cétones insaturées a , b
équivalents synthétiques
La formation des équivalents synthétiques indiqués de l'énol se fait par des réactions simples à haut rendement :
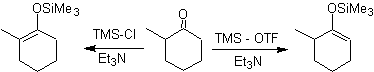
![]() Formation des silyl énol éthers :
Formation des silyl énol éthers :
Les dérivés de silylénol peuvent également être facilement préparés à partir d'esters et d'amides.
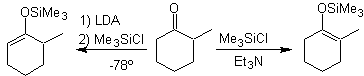
Les éthers de silylénol sont à utiliser de préférence dans le cas des aldéhydes, car ceux-ci s'énolisent avec les bases fortes, induisant une condensation d'aldol.
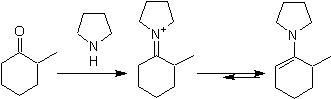
![]() Formation d'énamine :
Formation d'énamine :
La régiosélectivité peut être contrôlée par la combinaison appropriée d'effets électroniques et stériques.
![]() Formation d'éthers d'énol par réduction Birch :
Formation d'éthers d'énol par réduction Birch :
La régiosélectivité de la réduction est contrôlée par des effets électroniques.