Sintesi di antibiotici fluorochinolonici
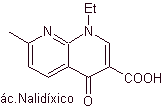
I chinoloni appartengono a un gruppo di agenti antibatterici sintetici. L'agente più antico di questa famiglia, l'acido nalidixico, utilizzato nei primi anni '60, ha un buon spettro contro gli enterobatteri (spettro antibatterico limitato) ma la sua farmacocinetica non è molto favorevole per l'uso clinico di routine a causa della sua bassa biodisponibilità nei tessuti e della sua metà corta -vita.
Per questo motivo è stato necessario sintetizzare nuovi antibatterici di questa famiglia per migliorare lo spettro di attività, il profilo farmacocinetico, ridurre gli effetti avversi e la comparsa di resistenza batterica. Questo nuovo gruppo sono i cosiddetti fluorochinoloni, generati durante gli anni '80.
|
Molti ricercatori concordano sul fatto che la reazione di Gould-Jacobs , è la base principale per la sintesi dei primi chinoloni ad uso farmacologico, avvenuta negli anni '60, tale reazione presenta la seguente sequenza:
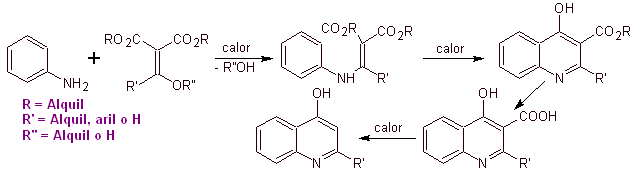
Negli anni successivi il fluoro in posizione 6 e vari gruppi di eterocicli in posizione 7 sono stati introdotti nell'anello basico dei benzochinoloni, dando origine a fluorochinoloni con maggior spettro antibatterico.
Parti importanti delle metodologie utilizzate in queste sintesi sono state compilate da Leyva S e Leyva E in un ottimo lavoro dal punto di vista biochimico.
Il metodo di disconnessione applicato al resoconto delle sintesi in studio e le reazioni dei primi stadi delle sintesi sono di esclusiva responsabilità dell'autore di questa monografia. .
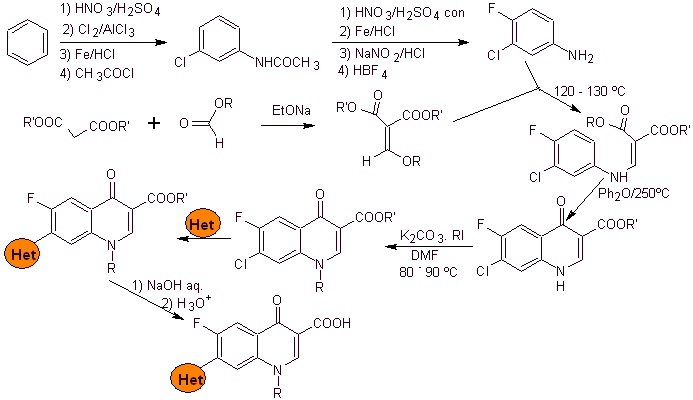
i) Sintesi riportata da Koga H. et al.
Analisi retrosintetica:
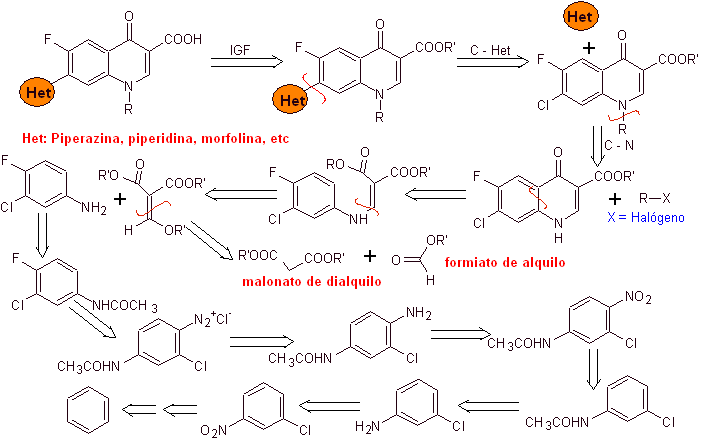
Sintesi: Parte dal benzene per formare 3-cloro-4-fluoroanilina, che reagisce con dietil EMME per produrre il corrispondente acrilato, che per riscaldamento forma un composto ciclico. Questo composto a sua volta viene fatto reagire con un agente alchilante e successivamente viene introdotto il composto eterociclico azotato, per idrolizzare infine ed ottenere la molecola bersaglio.
Analisi retrosintetica:
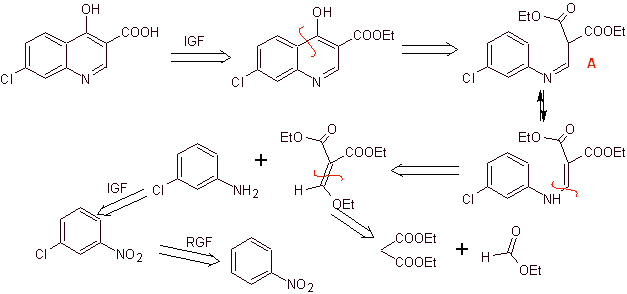
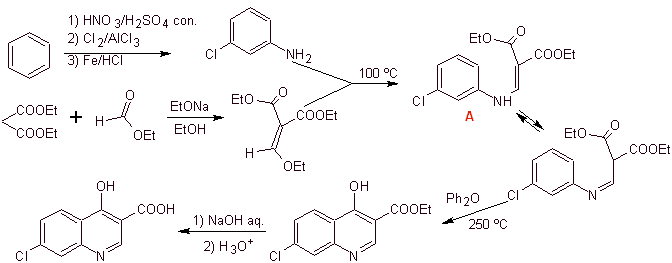
Sintesi: Partendo dal benzene, per formare 3-cloroanilina con dietil etossimetilenemalonato (EMMET) formato dalla condensazione di etil formiato e dietil malonato in un mezzo basico, per produrre il composto A, che viene successivamente riscaldato in presenza di un difenil etere per generare il composto ciclico della chinolina, che viene prontamente idrolizzato nell'acido corrispondente.
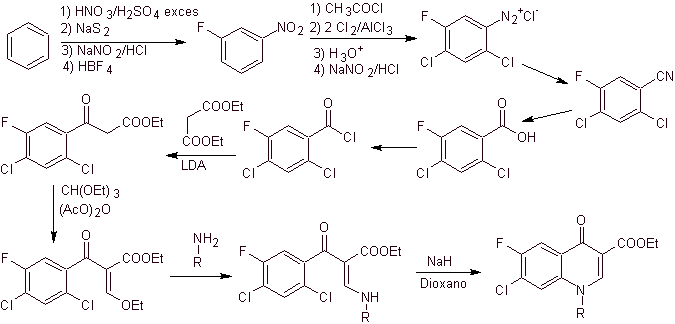
iii) Sintesi riportata da Grohe e Zeiler
Analisi retrosintetica: il legame CN inizia a essere disconnesso e l'ammina continua a essere disconnessa, per raggiungere il composto 1,3-diCO, che potrebbe essere disconnesso come tale, ma la reazione proposta dai suoi autori viene rispettata e il dietil malonato viene generato come intermedio, così come il derivato multialogenato del cloruro di benzoile.
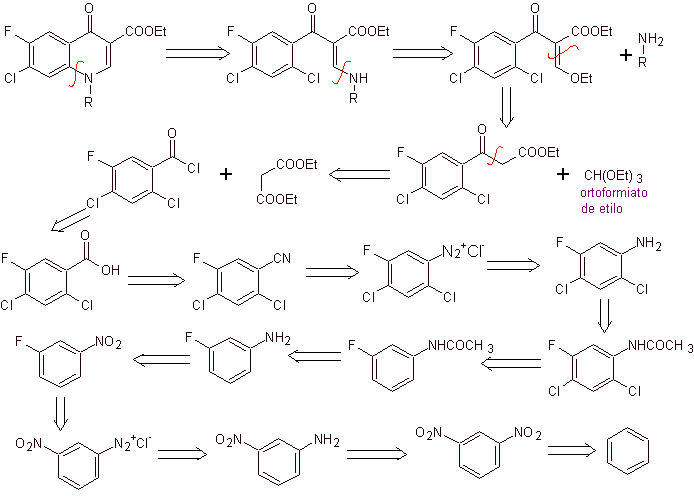
Sintesi. Dal benzene si può ottenere l'acetato di etile benzoile sostituito con fluoro e cloro nelle posizioni corrispondenti. Questo composto viene fatto reagire con trietil ortoformiato per produrre il corrispondente etossialchene, dove è possibile sostituire il gruppo etossilico con un gruppo amminico per produrre la rispettiva ammina, che viene ciclizzata con una base forte al fluorochinolone. come si può vedere fluoro, cloro o nitro partecipano come possibili gruppi uscenti alla reazione di ciclizzazione. Questo metodo è stato molto versatile ed è stato utilizzato nella sintesi di N-arile e N-alchile fluorochinoloni.
iv) Sintesi riportata da Grohe e Heitzer
Analisi retrosintetica .
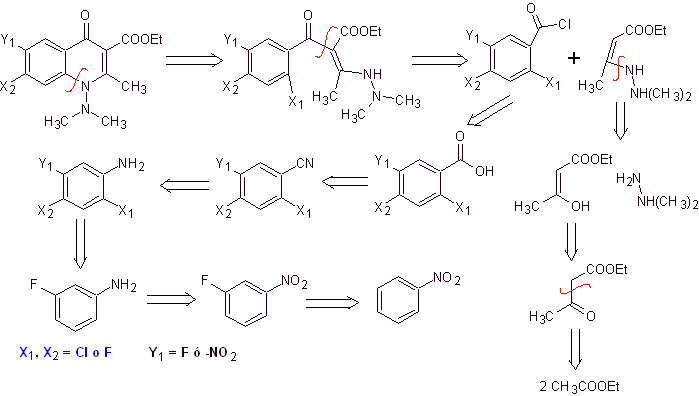
Sintesi. Si propone un percorso di sintesi convergente. Uno dei quali parte dalla condensazione di Claisen di due moli di acetato di etile, per produrre acetoacetato di etile, che si combina con il derivato metilato dell'idrazina, che forma la diammina viniloga, che verrà utilizzata nella reazione con il derivato del cloruro di benzoile, formato da nitrobenzene a causa dell'azione catalitica di un'ammina terziaria.
Il composto formato viene ciclizzato dalla catalisi di DBU (1,8-Diazabicil[5.4.0]undec-7-en), per produrre un fluorochinolone.
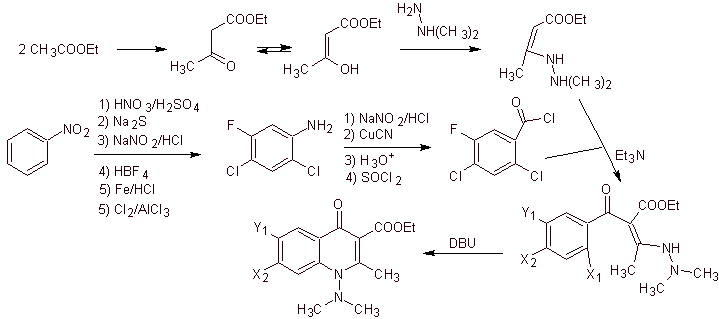
v) Sintesi riportata da Torii et al.
Analisi retrosintetica. Torii ei suoi collaboratori nel 1990 hanno riportato la sintesi di chinoloni fluorurati mediante un processo di ciclizzazione carbonilativa, catalizzata da Pd. Questo metodo è molto adatto per la sintesi di fluorochinoloni, sostituiti in posizione 2 (R = –Me, -CH 2 COOMe, –COOMe). Un'analisi retrosintetica di questo metodo inizia disconnettendosi al legame acilico e proponendo un organocadmio come molecola precursore o equivalente sintetico. Il resto delle disconnessioni porta all'anilina multisostituita. con alogeni, come segue:
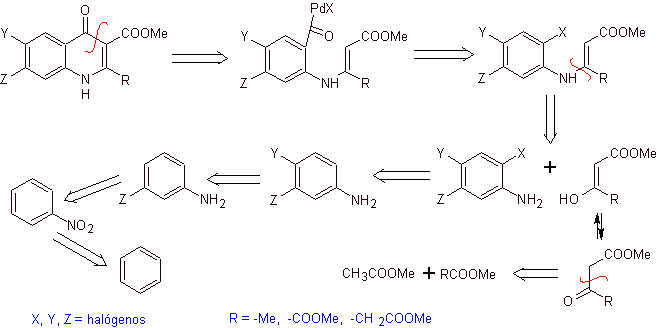
Sintesi. Il disegno di sintesi può essere ridisegnato attraverso un percorso convergente. La prima via si riferisce alla formazione di acetoacetato di etile e la seconda, partendo dal benzene fino all'anilina multialogenata, che ciclizzerà in condizioni di carbonizzazione catalitica in presenza di palladio. Un riscaldamento finale del sistema consente la ciclizzazione e la formazione del fluorochinolone.
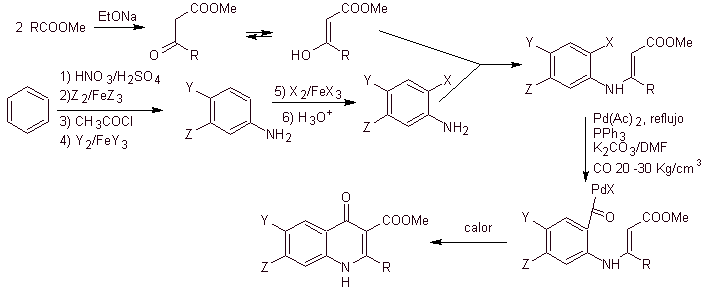
vi) Sintesi riportata da Miyamoto et al.
Analisi retrosintetica:
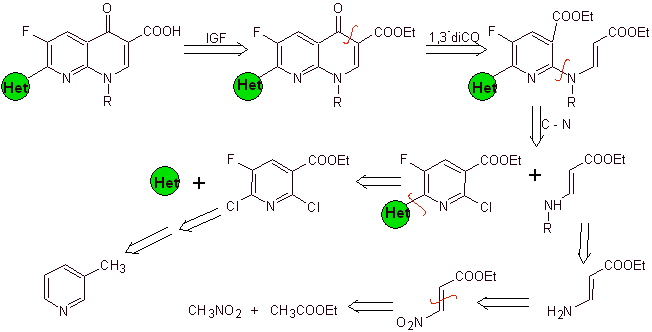
Sintesi. Poiché gli alogeni nelle posizioni 2 e 6 della piridina sono altamente reattivi, è possibile preparare chinoloni mediante la procedura mostrata da Miyamoto et al, in cui l'estere 2,6-dicloropiridinico viene fatto reagire con un'ammina ciclica per dare un intermedio che viene fatto reagire con la vinilammina, per poi ciclizzare in un mezzo basico. Idrolizzato si forma l'estere
il fluorochinolone.
In ogni caso, la formazione dell'estere alogenato nelle posizioni 2, 6 con cloro e F in 5. È la parte critica di questa sintesi. L'estere di piridina multialogenato può essere preparato dalla 3-metilpiridina (beta-picolina), che si ottiene dalla distillazione del catrame di carbone.
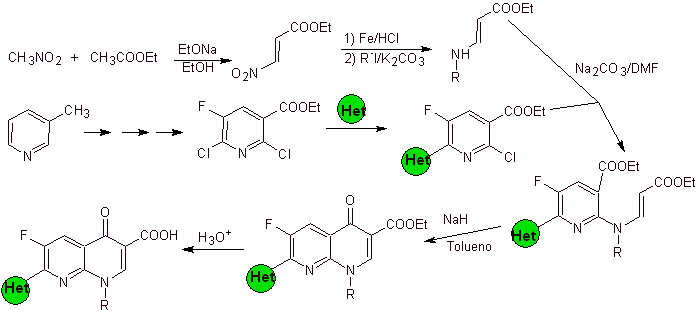
vii) Sintesi riportata da Hayakawa
Analisi retrosintetica: composti come la flumechina e l'ofloxacina hanno una struttura triciclica. La loro sintesi viene effettuata secondo Hayakawa et al., partendo da una struttura che contiene già l'anello eterociclico azotato.
Di conseguenza, inizia la disconnessione dal legame CO, risultante dall'acilazione dell'anello benzenico, e continua la disconnessione CN, che lascia una struttura biciclica e EMME (dietil etossimetilene malonato) come equivalenti sintetici. La continuità della disconnessione dipende dalla natura di X (-CH 3 , O, S). nel caso sia O o S la disconnessione può essere simultanea come indicato. Le seguenti operazioni sono IGF che lasciano intravedere il benzene come materiale di partenza.
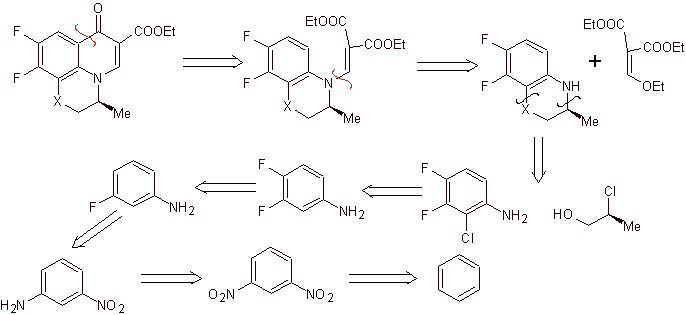
Sintesi. Le reazioni di Sandmeyer possono essere opportunamente combinate per introdurre F e creare le condizioni strutturali per introdurre il cloro. La formazione dell'eterociclo può essere effettuata con 2-cloropropanolo, formato dall'apertura di un opportuno epossido. Il resto delle reazioni che prevedono l'utilizzo di EMME sono già note con le metodiche precedentemente viste per la sintesi dei fluorochinoloni.
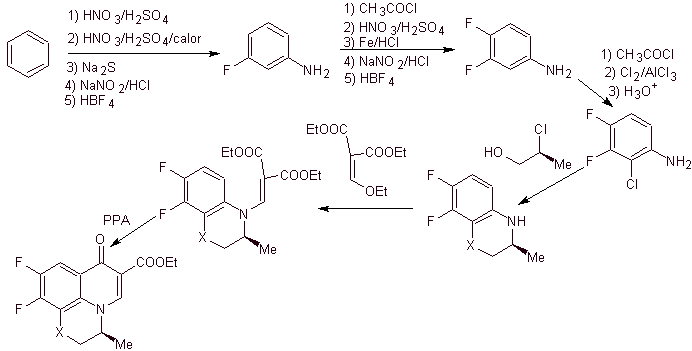
viii) Sintesi riportata da Egawa et al.
Analisi retrosintetica . Il composto triciclico comincia ad essere disconnesso dal legame C-O, aspetto che ci permette di vedere che questo legame era il risultato di una ciclizzazione intramolecolare di un composto –OH con la F del benzene. Una seconda disconnessione CN genera una molecola precursore amminico EMME. Le seguenti disconnessioni sono ben note.
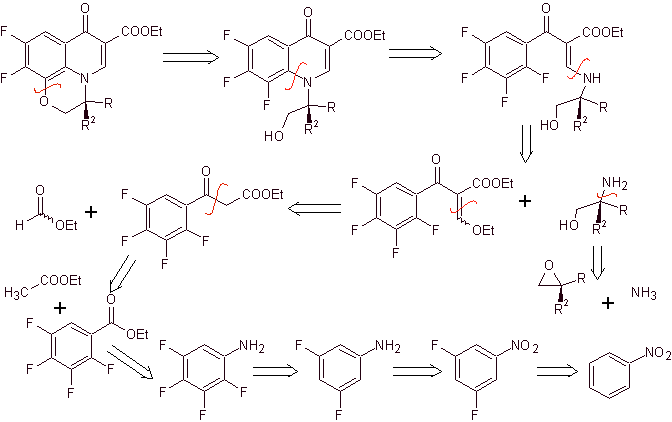
Sintesi. La fluorizzazione esaustiva, con metodi indiretti del benzene, si ottiene dapprima utilizzando il nitrobenzene come materiale di partenza, trasformandolo poi in un'ammina o ammide, in modo da occupare le altre posizioni.
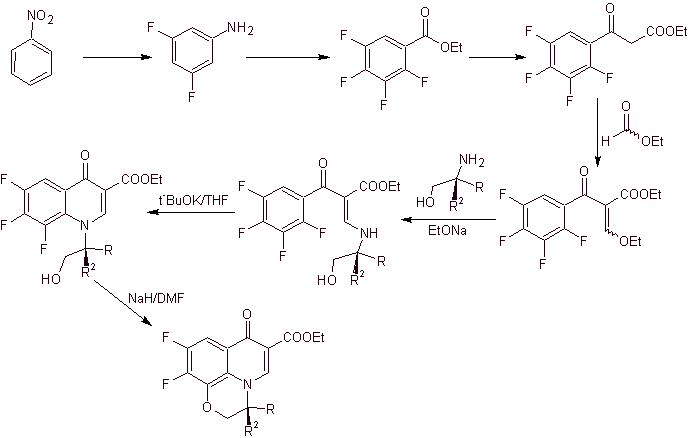
ix) Sintesi riportata da Matsumoto et al.
Analisi retrosintetica.
Sintesi: Nella procedura riportata da Matsumoto et al. è stata nuovamente utilizzata la reazione di Gould-Jacobs; partendo da una nitropiridina diclorurata, sono stati sintetizzati gli intermedi, prima con
Il terzo ciclo si ottiene utilizzando EMME e alchilando l'ammina con ioduro di etile, idrolizzando infine i gruppi ammidici ed estere.
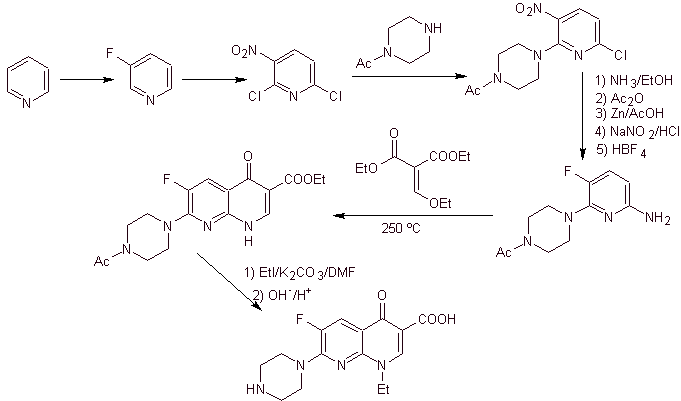
X) Sintesi riportata da Chu et al.
Analisi retrosintetica: inizia disconnettendo il legame CN dell'eterociclo e continua con il CN dell'ammina viniloga. In EMME, viene disconnesso dal doppio legame, per produrre formiato di etile come molecola precursore, la successiva disconnessione è di tipo 1,3-diCO, che ci collegherà alla condensazione di Claisen.Quindi l'estere aromatico risultante viene sottoposto a vari IGF, fino ad arrivare al nitrobenzene come materiale di partenza
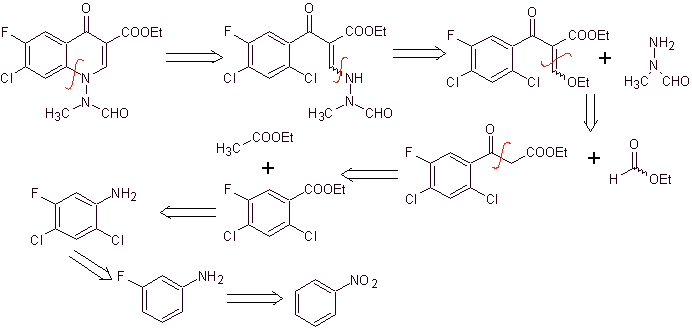
Sintesi. Si può partire dal nitrobenzene, e con le dovute reazioni, arrivare agli etil benzoati opportunamente sostituiti con F e Cl, da cui si utilizza la condensazione di Claisen seguita da un'altra condensazione di Knoevenagel con formiato di etile. Questo intermedio viene quindi fatto reagire con N-formil-N-metilidrazina e con l'aggiunta di NaH si ottiene la ciclizzazione per arrivare al composto finale.
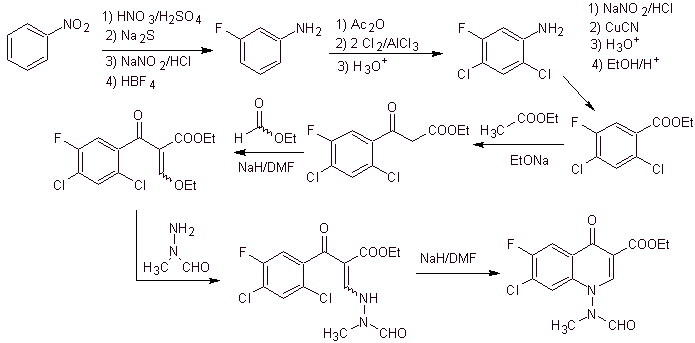
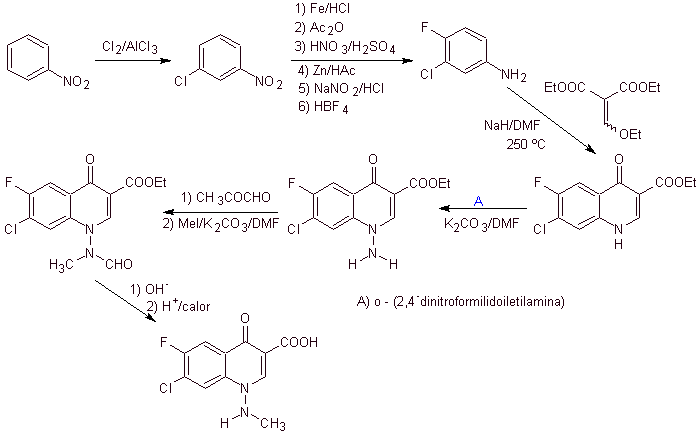
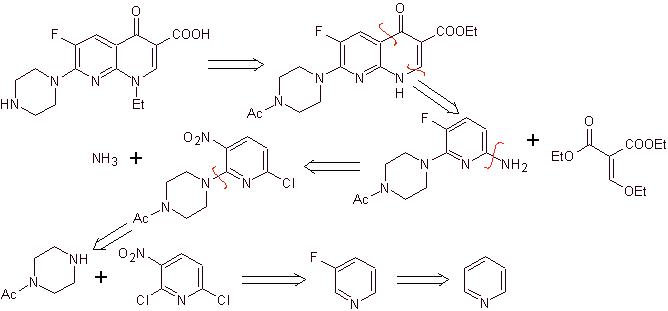
xi) Sintesi riportata da Wenthand et al.
Analisi retrosintetica I chinoloni con un gruppo amminico sostituito in posizione 1, come l'amifloxacina, possono essere sintetizzati seguendo la metodologia descritta da Wentland. Per questo motivo, le disconnessioni vengono avviate dal collegamento N-C. e poi continua con il legame NN e la chiusura dell'anello, segue la reazione di Gould-Jacobs.
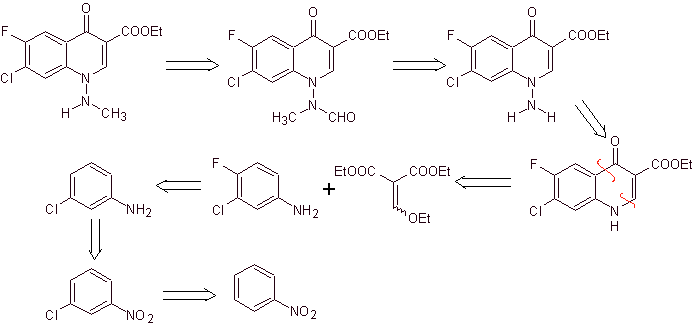
sintesi . In questo caso, il gruppo amminico del chinolone viene fatto reagire con un reagente che trasferisce un altro gruppo amminico, che viene successivamente convertito in un derivato della formammide per trasformarlo successivamente nel composto 1-(N-metil)-7-cloro- Acido 6-fluoro-1,4-diidro-4-osso-chinolin-3-carbossilico.