Synthèse des antibiotiques Fluoroquinolones
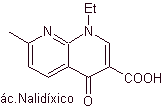
Les quinolones appartiennent à un groupe d'agents antibactériens synthétiques. L'agent le plus ancien de cette famille, l'acide nalidixique, utilisé au début des années 1960, possède un bon spectre contre les entérobactéries (spectre antibactérien limité) mais sa pharmacocinétique n'est pas très favorable pour une utilisation clinique de routine en raison de sa faible biodisponibilité dans les tissus et de sa courte moitié -vie.
Pour cette raison, il était nécessaire de synthétiser de nouveaux antibactériens de cette famille pour améliorer le spectre d'activité, le profil pharmacocinétique, réduire les effets indésirables et l'apparition de résistances bactériennes. Ce nouveau groupe sont les soi-disant fluoroquinolones, générés au cours des années 80.
|
|
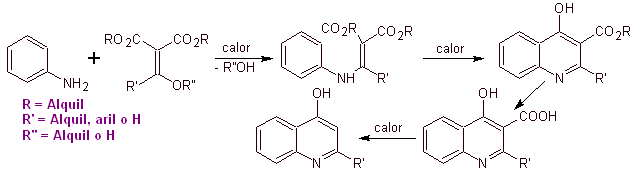
De nombreux chercheurs s'accordent à dire que la réaction de Gould-Jacobs , est la base principale de la synthèse des premières quinolones à usage pharmacologique, survenue dans les années 1960, cette réaction présente la séquence suivante :
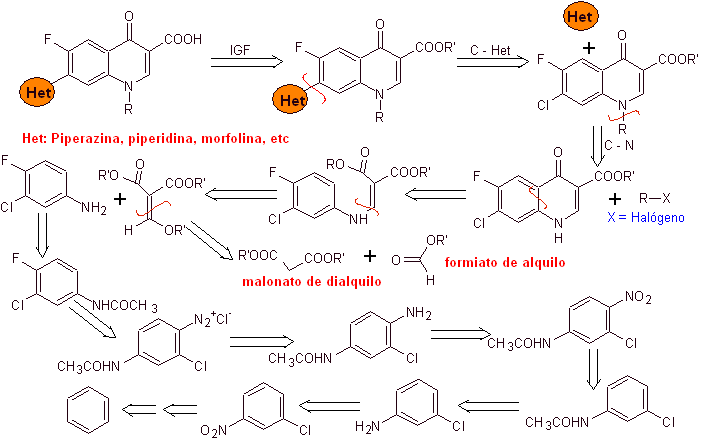
Dans les années suivantes, le fluor en position 6 et divers groupes d'hétérocycles en position 7 ont été introduits dans le cycle basique des benzoquinolones, donnant naissance à des fluoroquinolones à plus grand spectre antibactérien.
Des parties importantes des méthodologies utilisées dans ces synthèses ont été compilées par Leyva S et Leyva E très bon travail d'un point de vue biochimique.
La méthode de déconnexion appliquée au rapport des synthèses étudiées et les réactions des premières étapes des synthèses relèvent de la seule responsabilité de l'auteur de cette monographie. .
i) Synthèse rapportée par Koga H. et al.
Analyse rétrosynthétique :
Synthèse : Il part du benzène pour former la 3-chloro-4-fluoroaniline, qui réagit avec le diéthyl EMME pour produire l'acrylate correspondant, qui lors du chauffage forme un composé cyclique. Ce composé est à son tour mis à réagir avec un agent alkylant puis le composé hétérocyclique azoté est introduit, pour finalement hydrolyser et obtenir la molécule cible.
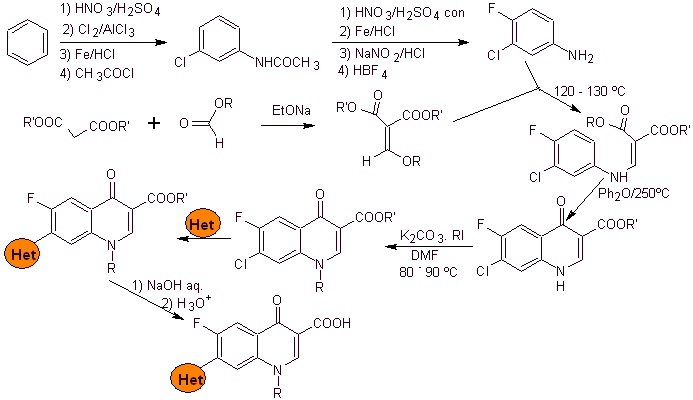
ii) Synthèse rapportée par Price et Roberts
Analyse rétrosynthétique :
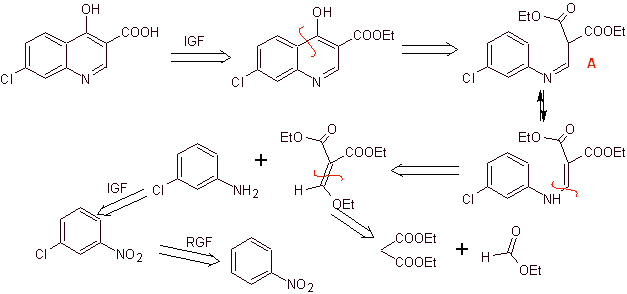
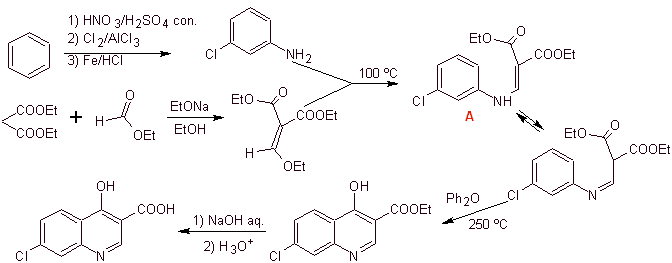
Synthèse : A partir du benzène, former la 3-chloroaniline avec le diéthyl éthoxyméthylène malonate (EMMET) formé par la condensation du formiate d'éthyle et du diéthyl malonate en milieu basique, pour donner le composé A, qui est ensuite chauffé en présence d'un diphényl éther pour générer le composé cyclique quinoléine, qui est facilement hydrolysé en acide correspondant.
iii) Synthèse rapportée par Grohe et Zeiler
Analyse rétrosynthétique : La liaison CN commence à se déconnecter et l'amine continue à se déconnecter, pour atteindre le composé 1,3-diCO, qui pourrait se déconnecter tel quel, mais la réaction proposée par ses auteurs est respectée et le malonate de diéthyle est généré comme intermédiaire, ainsi que le dérivé multihalogéné du chlorure de benzoyle.
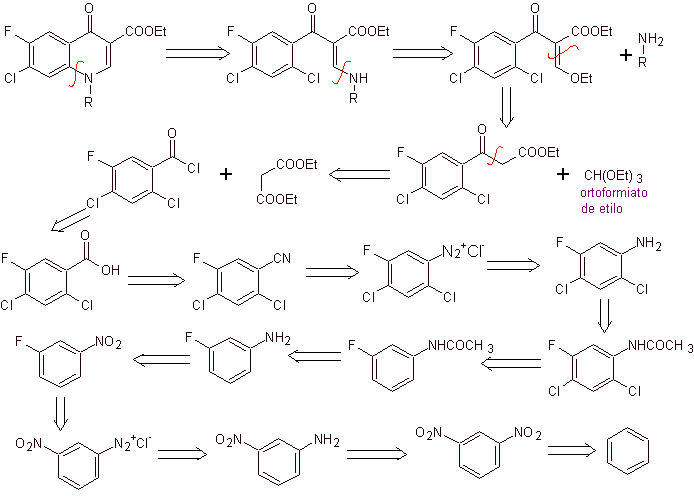
La synthèse. A partir du benzène , l'acétate d'éthylbenzoyle peut être obtenu substitué par du fluor et du chlore dans les positions correspondantes. Ce composé est mis à réagir avec de l'orthoformiate de triéthyle pour produire l'éthoxyalcène correspondant, où il est possible de remplacer le groupe éthoxy par un groupe amino pour produire l'amine respective, qui est cyclisée avec une base forte en fluoroquinolone. comme on peut le voir le fluor, le chlore ou le nitro participent en tant que groupes partants possibles à la réaction de cyclisation. Cette méthode a été très polyvalente et a été utilisée dans la synthèse de N-aryl et N-alkyle les fluoroquinolones.
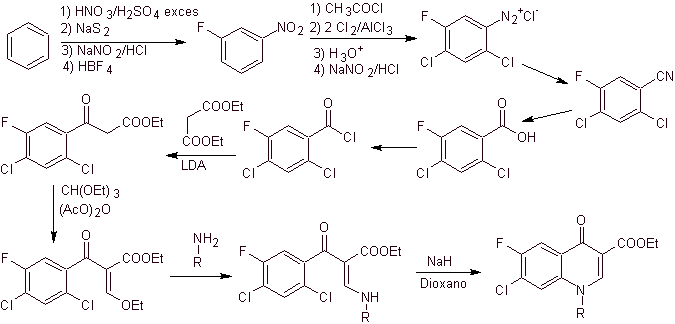
iv) Résumé rapporté par Grohe et Heitzer
Analyse rétrosynthétique .
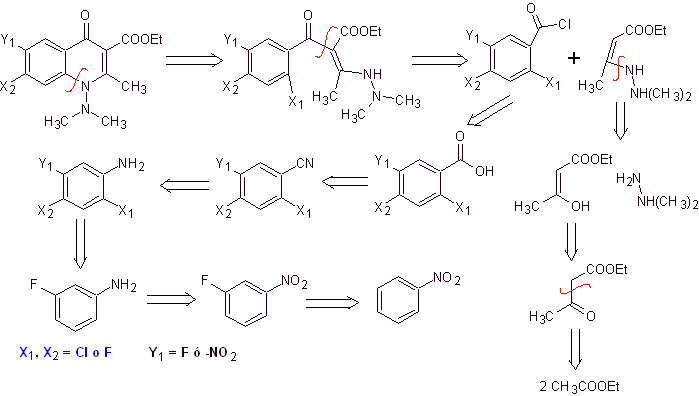
La synthèse. Une voie de synthèse convergente est proposée. Dont l'une part de la condensation de Claisen de deux moles d'acétate d'éthyle, pour produire l'acétoacétate d'éthyle, qui est combiné avec le dérivé méthylé de l'hydrazine, qui forme la diamine vinylologue, qui sera utilisée dans la réaction avec le dérivé du chlorure de benzoyle, formé à partir de nitrobenzène en raison de l'action catalytique d'une amine tertiaire.
Le composé formé est cyclisé par la catalyse du DBU (1,8-Diazabicil[5.4.0]undec-7-en), pour produire une fluoroquinolone.
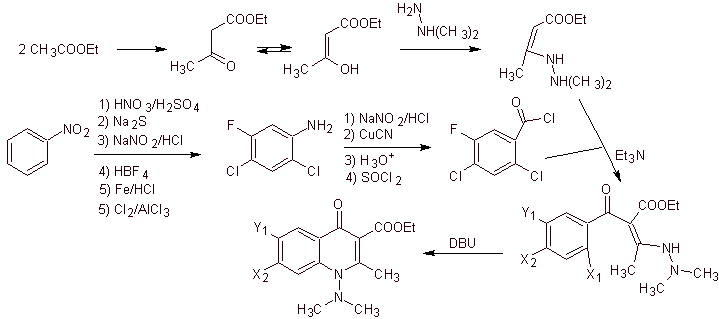
v) Synthèse rapportée par Torii et al.
Analyse rétrosynthétique. Torii et ses collaborateurs ont rapporté en 1990 la synthèse de quinolones fluorées au moyen d'un processus de cyclisation carbonylative, catalysée par Pd. Cette méthode est bien adaptée à la synthèse des fluoroquinolones, substituées en position 2 (R = –Me, -CH 2 COOMe, –COOMe). Une analyse rétrosynthétique de cette méthode commence par se déconnecter au niveau de la liaison acyle et proposer un organocadmium comme molécule précurseur ou équivalent synthétique. Le reste des déconnexions conduit à de l'aniline multisubstituée. avec des halogènes, comme suit :
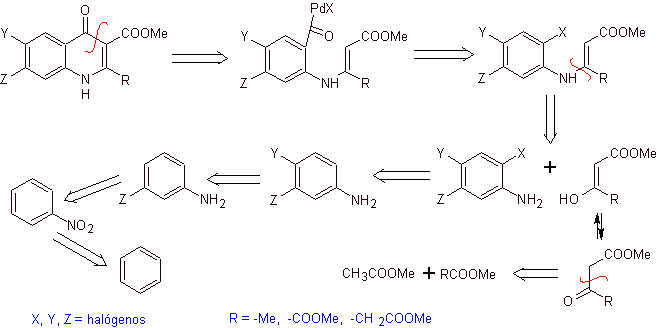
La synthèse. La conception de synthèse peut être esquissée à nouveau par une voie convergente. La première voie fait référence à la formation d'acétoacétate d'éthyle et la seconde partant du benzène en aniline multihalogénée, qui va se cycliser dans des conditions de carbonisation catalytique en présence de palladium. Un chauffage final du système permet la cyclisation et la formation de la fluoroquinolone.
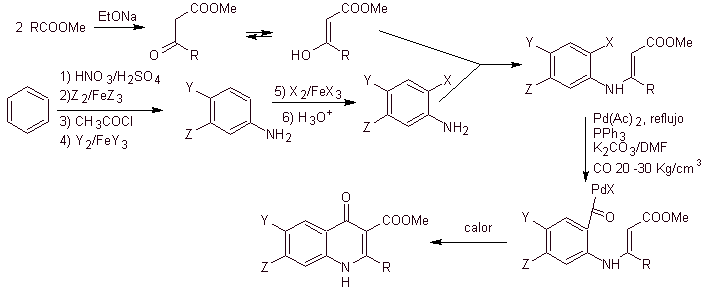
vi) Synthèse rapportée par Miyamoto et al.
Analyse rétrosynthétique :
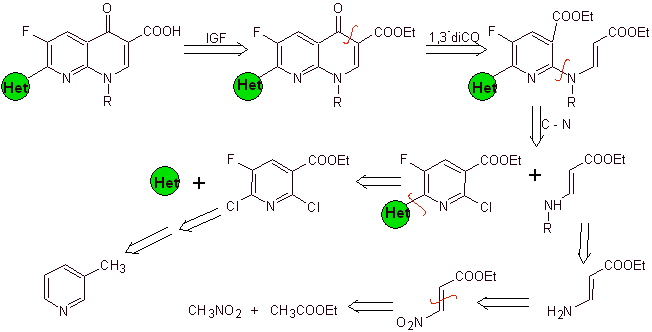
La synthèse. Étant donné que les halogènes aux positions 2 et 6 de la pyridine sont hautement réactifs, il est possible de préparer des quinolones par la procédure décrite par Miyamoto et al, dans laquelle l'ester de 2,6-dichloropyridine est mis à réagir avec une amine cyclique pour donner un intermédiaire que l'on fait réagir avec la vinylamine, pour ensuite cycliser en milieu basique. Hydrolysé l'ester se forme la fluoroquinolone.
Dans tous les cas, la formation de l'ester halogéné aux positions 2, 6 avec le chlore et F en 5. C'est la partie critique de cette synthèse. L'ester de pyridine multihalogéné peut être préparé à partir de la 3-méthylpyridine (bêta-picoline), qui est obtenue à partir de la distillation du goudron de houille.
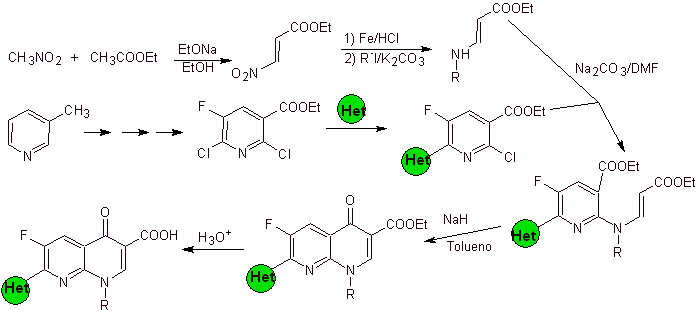
vii) Synthèse rapportée par Hayakawa
Analyse rétrosynthétique : Des composés tels que la fluméquine et l'ofloxacine ont une structure tricyclique. Leur synthèse est réalisée selon Hayakawa et al., à partir d'une structure contenant déjà l'hétérocycle azoté.
Par conséquent, la déconnexion par la liaison CO commence, résultant de l'acylation du cycle benzénique, et la déconnexion CN se poursuit, ce qui laisse une structure bicyclique et l'EMME (diéthyl éthoxyméthylène malonate) comme équivalents synthétiques. La continuité de la déconnexion dépend de la nature de X (-CH 3 , O, S). dans le cas d'être O ou S, la déconnexion peut être simultanée comme indiqué. Les opérations suivantes sont des IGF qui permettent d'entrevoir le benzène comme matière première.
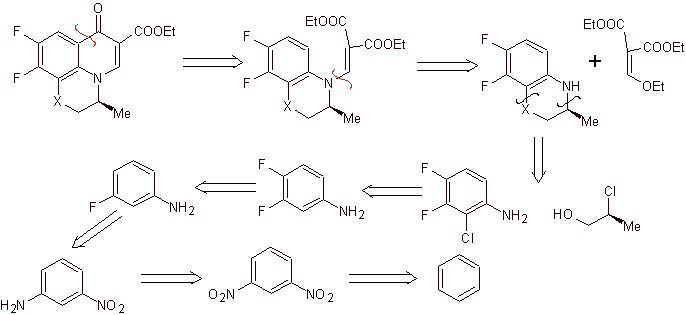
La synthèse. Les réactions de Sandmeyer peuvent être combinées de manière appropriée pour introduire du F et créer des conditions structurelles pour introduire du chlore. La formation de l'hétérocycle peut être réalisée avec du 2-chloropropanol, formé à partir de l'ouverture d'un époxyde approprié. Le reste des réactions qui incluent l'utilisation d'EMME sont déjà connues par les méthodes vues précédemment pour la synthèse des fluoroquinolones.
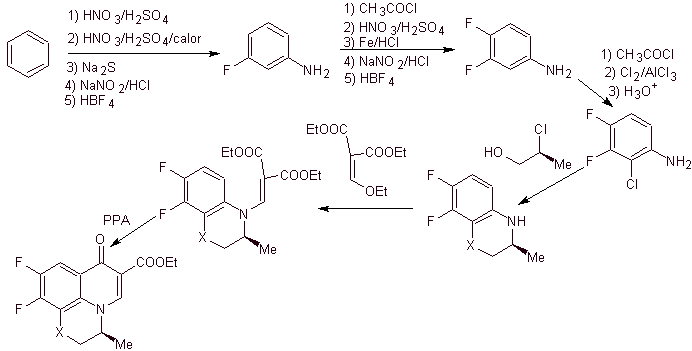
viii) Synthèse rapportée par Egawa et al.
Analyse rétrosynthétique . Le composé tricyclique commence à être déconnecté par la liaison C-O, un aspect qui nous permet de voir que cette liaison était le résultat d'une cyclisation intramoléculaire d'un composé -OH avec le F du benzène. Une deuxième déconnexion CN génère une molécule précurseur aminée EMME. Les déconnexions suivantes sont bien connues.
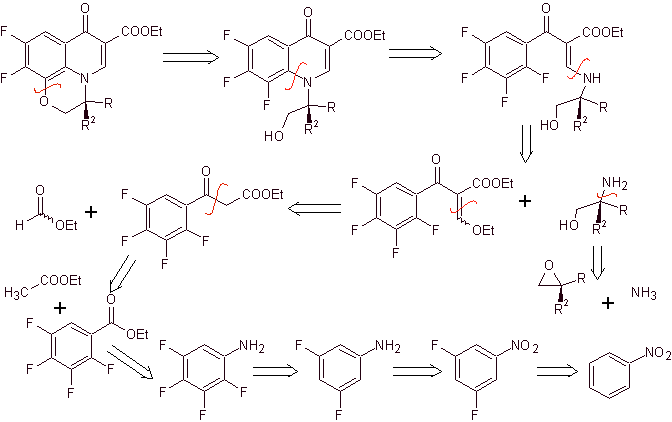
La synthèse. La fluoration exhaustive, par voie indirecte du benzène, est réalisée d'abord en utilisant le nitrobenzène comme matière première, puis en le transformant en amine ou amide, afin d'occuper les autres positions.
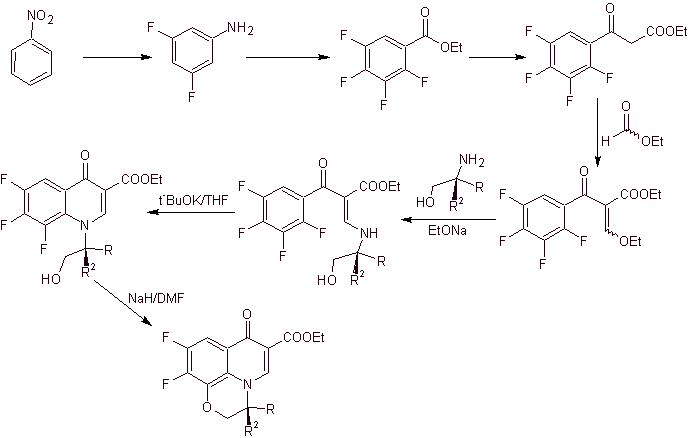
ix) Synthèse rapportée par Matsumoto et al.
Analyse rétrosynthétique.
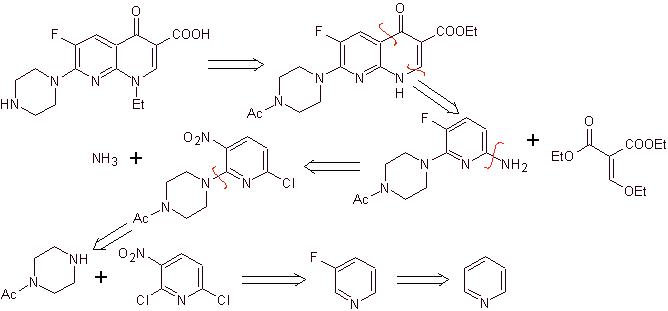
Synthèse : Dans la procédure rapportée par Matsumoto et al. la réaction de Gould-Jacobs a de nouveau été utilisée ; à partir d'une nitropyridine dichlorée, les intermédiaires ont été synthétisés, d'abord avec
Le troisième cycle est réalisé en utilisant EMME et en alkylant l'amine avec de l'iodure d'éthyle, en hydrolysant finalement les groupes amide et ester.
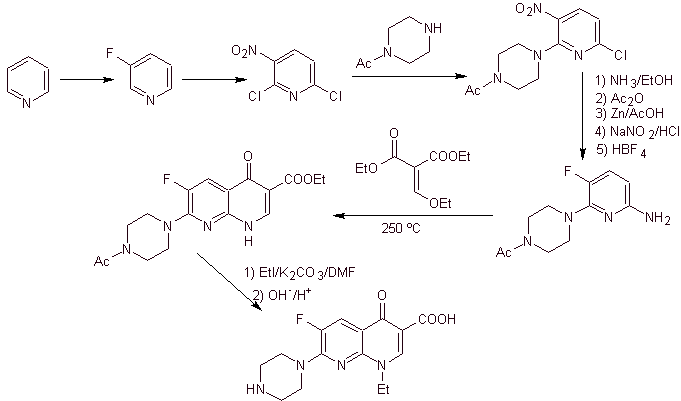
X) Synthèse rapportée par Chu et al.
Analyse rétrosynthétique : Elle commence par déconnecter la liaison CN de l'hétérocycle et se poursuit avec le CN de l'amine vinylogène. Dans l'EMME, il est déconnecté par la double liaison, pour produire du formiate d'éthyle comme molécule précurseur, la déconnexion suivante est de type 1,3-diCO, qui va nous lier à la condensation de Claisen, puis l'ester aromatique résultant est soumis à divers IGF, jusqu'à atteindre le nitrobenzène comme matière première
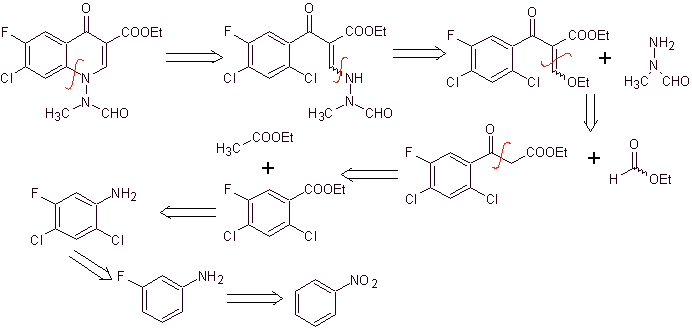
La synthèse. On peut partir du nitrobenzène, et avec les réactions nécessaires, arriver au benzoate d'éthyle convenablement substitué par F et Cl, à partir duquel on utilise la condensation de Claisen suivie d'une autre condensation de Knoevenagel avec le formiate d'éthyle. Cet intermédiaire est ensuite mis à réagir avec la N-formyl-N-méthylhydrazine et avec l'ajout de NaH, la cyclisation est réalisée pour arriver au composé final.
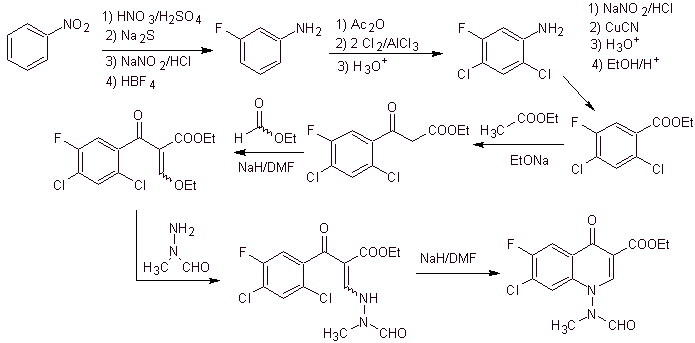
xi) Synthèse rapportée par Wenthand et al.
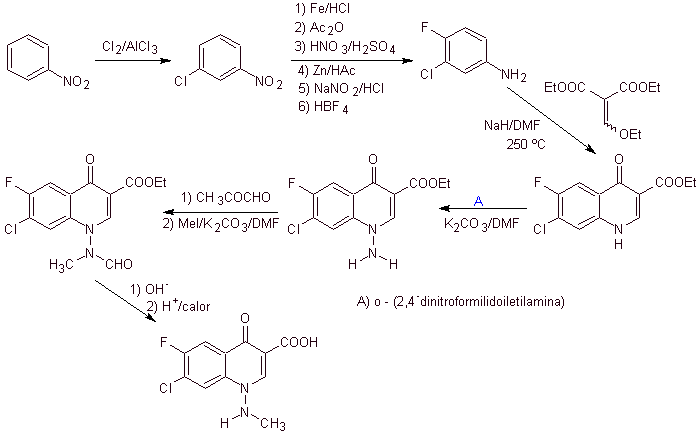
Analyse rétrosynthétique Les quinolones avec un groupe amino substitué en position 1, comme l'amifloxacine, peuvent être synthétisées selon la méthodologie décrite par Wentland. Pour cette raison, les déconnexions sont initiées par la liaison N-C. puis cela continue avec la liaison NN et la fermeture de l'anneau, la réaction de Gould-Jacobs suit.
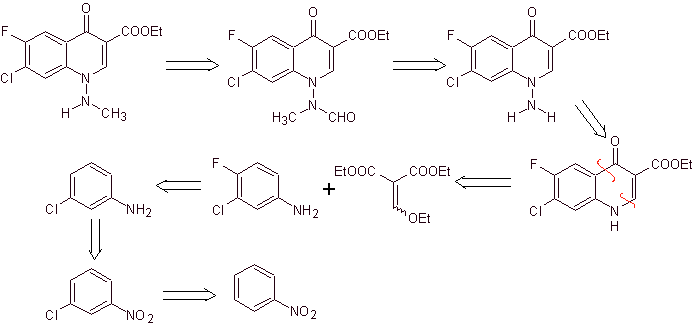
synthèse . Dans ce cas, le groupe amino de la quinolone est mis à réagir avec un réactif qui transfère un autre groupe amino, qui est ensuite converti en un dérivé formamide pour le transformer ultérieurement en composé 1-(N-méthyl)-7-chloro - Acide 6-fluoro-1,4-dihydro-4-oxo-quinoline-3-carboxylique.