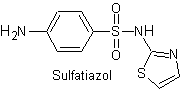
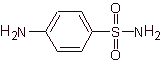
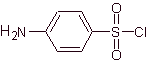
SINTESI SULFAMIDE
È noto che i sulfonamidi sono stati i primi antimicrobici ad essere utilizzati a livello sistemico. La sua struttura chimica è un nucleo benzenico con gruppi amminici che gli conferiscono la sua attività. Il gruppo amminico viene acetilato nel fegato, inattivandolo. A seconda del sostituente in detto settore il farmaco è più attivo.
Data la sua somiglianza con l'acido para-aminobenzoico, si comporta da inibitore competitivo di questa sostanza, necessaria insieme alla diidropteridina per sintetizzare l'acido diidrofolico, composto intermedio nella via di sintesi dei folati.
A differenza degli organismi più avanzati, i batteri hanno bisogno di sintetizzare i propri folati [non li acquisiscono dall'ambiente], quindi i sulfamidici, inibendo questo processo, inibiscono i processi di sintesi degli acidi nucleici e sono BATTERIOSTATICI.
TRIMETROPRIMA
Il trimetoprim è un derivato di 2,4 diaminopirimidine come | Questo composto INIBISCE l'enzima diidrofolato reduttasi e previene la formazione di acido tetraidrofolico, cioè agiscono nella stessa via metabolica dei sulfamidici, ma in una successiva reazione enzimatica. Il trimetoprim non viene mai utilizzato da solo, ma quando associato ai sulfamidici si potenziano in modo tale da diventare BATTERICIDI, diminuire la possibilità di generare resistenza e aumentare lo spettro antimicrobico. L'associazione tra sulfametossazolo e trimetoprim è fissa: 1:5. Ad esempio, i preparati commerciali Cotrimoxazole [forte o no] hanno questo motivo. |
sulfonamidi, sono generalmente classificati in base alla durata della loro azione e al modo in cui viene applicato il farmaco, nonché ad altre caratteristiche. A seconda della modalità di azione, i sulfamidici possono essere:
A)
Sulfonamidi ad azione breve o intermedia.
A. Uso generale sulfamidici
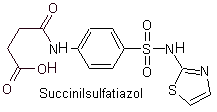
Yo. Sulfatiazolo
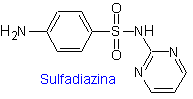
ii. sulfadiazina
iii. Sulfadimidina
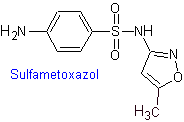
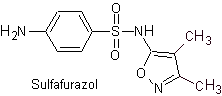
iv. Sulfametossazolo (da solo o associato a trimetoprim: cotrimossazolo)
B. Composti altamente solubili inizialmente utilizzati nel trattamento delle infezioni del tratto urinario.
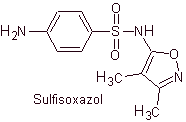
Yo. Sulfisossazolo
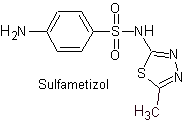
ii. sulfametizolo
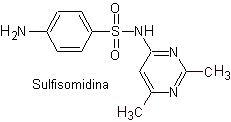
iii. Sulfasomidina
B)
Sulfonamidi a lunga durata d'azione.
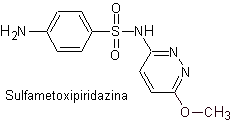
iv. sulfametossipiridazina
v. sulfadimetossina
sega. Sulfadossina
C)
Sulfamidici limitati al tratto gastrointestinale
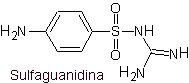
vii. Sulfaguanidina
viii. Sulfatalidina
ix. Sulfasuxidina
X. Sulfazolazina
D) Sulfamidici topici.
xi. acetato di mafenide
xii. sulfadiazina d'argento
XIII. sul facetammide sodico
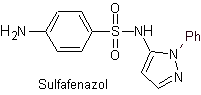
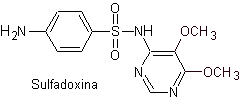
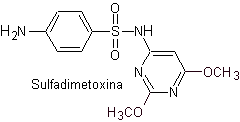
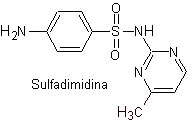
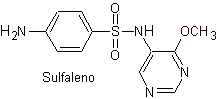
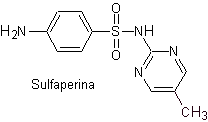
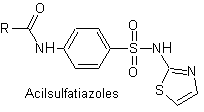
Principali sulfamidici:
| ……… |
|
|
|
| …….. |
|
|
|
| …….. |
|
|
|
| …….. |
|
|
| |
|
|
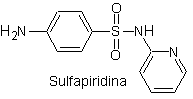
Le strutture che presentano i solfati, presentano generalmente due parti, una delle quali è quella corrispondente 4-amminobenzensolfammide o 4-amminobenzensolfonico cloruro, a seconda della reazione utilizzata per formare il solfato, e l'altra parte è generalmente un eterociclo, che ovviamente varia a seconda del particolare solfato in questione.
4-amminobenzensolfammide | …. |
4-amminobenzensolfonico cloruro |
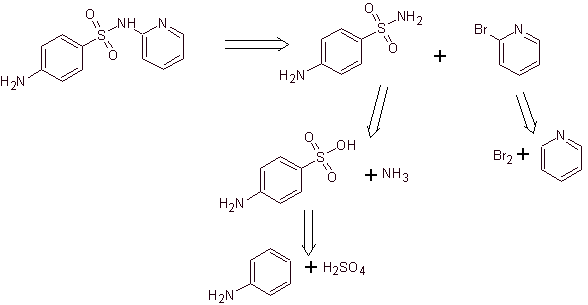
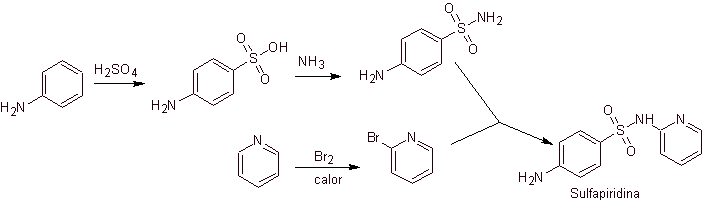
Sintesi di 4-aminobenzenesulfamide e
Cloruro di 4-amminobenzensolfonico :
Analisi retrosintetica:
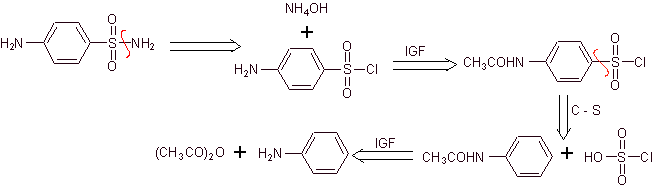
Sintesi:
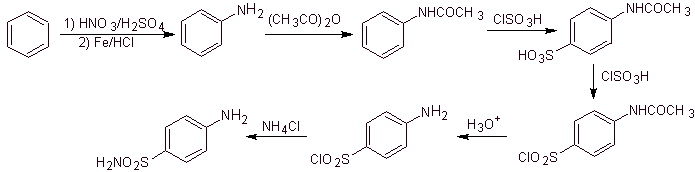
D'altra parte, è anche possibile ricorrere a una qualsiasi delle seguenti reazioni, per formare i substrati (equivalenti sintetici): che sono necessari, per sintetizzare i vari sulfamidici, a seconda dei casi:
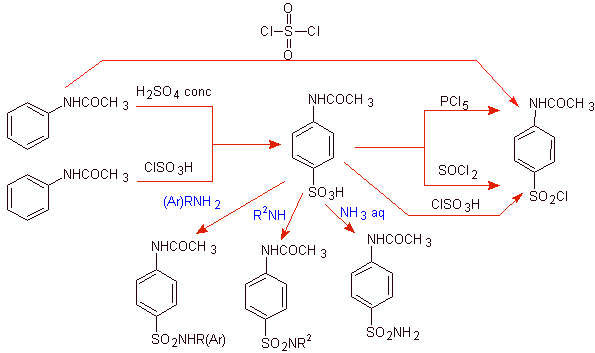
Gli aspetti della strategia utilizzati in modo ricorrente sono legati ai seguenti criteri:
![]() Il gruppo amminico dell'anilina viene protetto per acilazione, per evitare la formazione dell'ammide solfonica, con i reagenti utilizzati per la solfonazione del benzene: H 2 SO 4 , ClSO 3 H o SO 2 Cl 2 e
Il gruppo amminico dell'anilina viene protetto per acilazione, per evitare la formazione dell'ammide solfonica, con i reagenti utilizzati per la solfonazione del benzene: H 2 SO 4 , ClSO 3 H o SO 2 Cl 2 e
![]() Il gruppo acetammido di (acetanilide) può essere idrolizzato prima della reazione con l'eterociclo per formare il solfato. In alternativa si procede all'idrolisi controllata stereoselettivamente, alla fine con HCl diluito, poiché il gruppo ammidico dell'acetanilide è il primo ad idrolizzare.
Il gruppo acetammido di (acetanilide) può essere idrolizzato prima della reazione con l'eterociclo per formare il solfato. In alternativa si procede all'idrolisi controllata stereoselettivamente, alla fine con HCl diluito, poiché il gruppo ammidico dell'acetanilide è il primo ad idrolizzare.
Esempio. Sintetizza sulfadiazina (MOb 10), sulfatiazolo (MOb 11) e sulfisossazolo (MOb 12), da materiali semplici e convenienti.
MOb 10, Analisi retrosintetica. La disconnessione è avviata dal legame sulfonamidico, risultando in due semplici equivalenti sintetici. Uno di questi è il cloruro 4-aminobenzensolfonico, l'altro è la 2-aminopirimidina, un eterociclo la cui sintesi non è molto difficile.
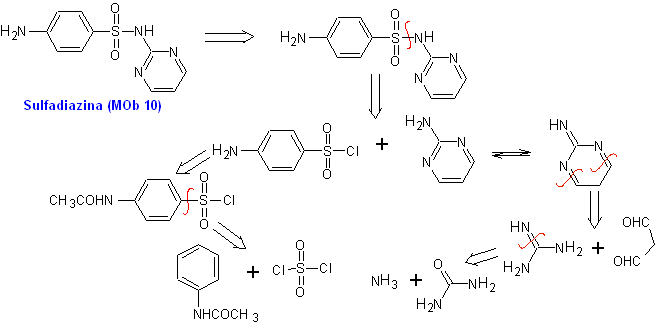
Sintesi di
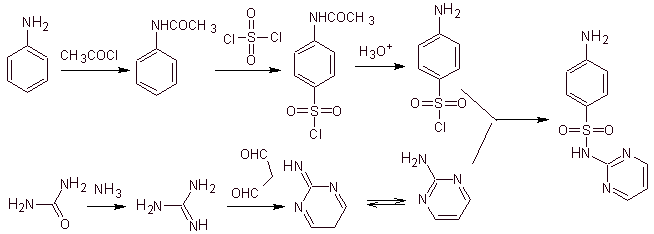
MOb 11. Analisi retrosintetica: la disconnessione genera p-aminobenzensolfonico cloruro e l'eterociclo 2-amino-1,3,tiazolo.
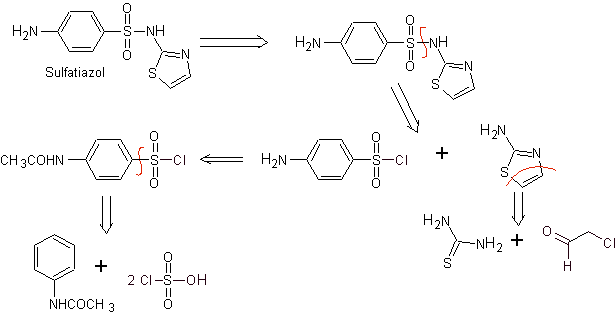
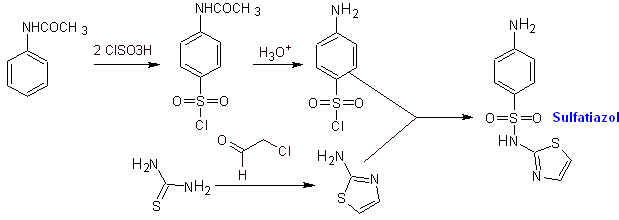
Sintesi di
MOb 12. Analisi retrosintetica: la disconnessione dà origine a un nuovo eterociclo, 5-ammino-3,4-dimetil-1,2-ossazolo
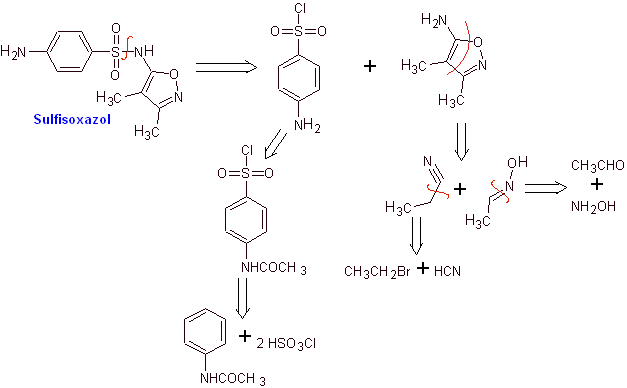
Sintesi di
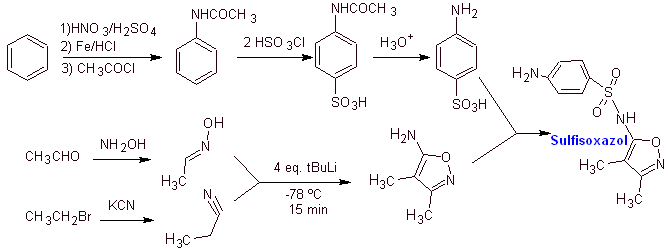
MOb 13. Sintesi di
analisi retrosintetica