Synthese von Fluorchinolon-Antibiotika
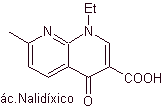
Chinolone gehören zu einer Gruppe synthetischer antibakterieller Wirkstoffe. Das älteste Mittel dieser Familie, Nalidixinsäure, das in den frühen 1960er Jahren verwendet wurde, hat ein gutes Spektrum gegen Enterobakterien (begrenztes antibakterielles Spektrum), aber seine Pharmakokinetik ist aufgrund seiner geringen Bioverfügbarkeit in Geweben und seiner kurzen Hälfte für den routinemäßigen klinischen Einsatz nicht sehr günstig -Leben.
Aus diesem Grund war es notwendig, neue Antibiotika dieser Familie zu synthetisieren, um das Wirkungsspektrum und das pharmakokinetische Profil zu verbessern, Nebenwirkungen und das Auftreten von Bakterienresistenzen zu reduzieren. Diese neue Gruppe sind die sogenannten Fluorchinolone, die in den 80er Jahren entwickelt wurden.
|
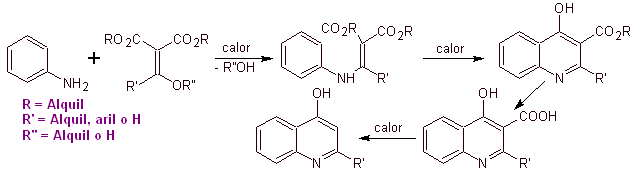
Viele Forscher sind sich einig, dass die Gould-Jacobs-Reaktion , die Hauptgrundlage für die Synthese der ersten Chinolone für die pharmakologische Verwendung ist, die in den 1960er Jahren stattfand, weist diese Reaktion die folgende Sequenz auf:
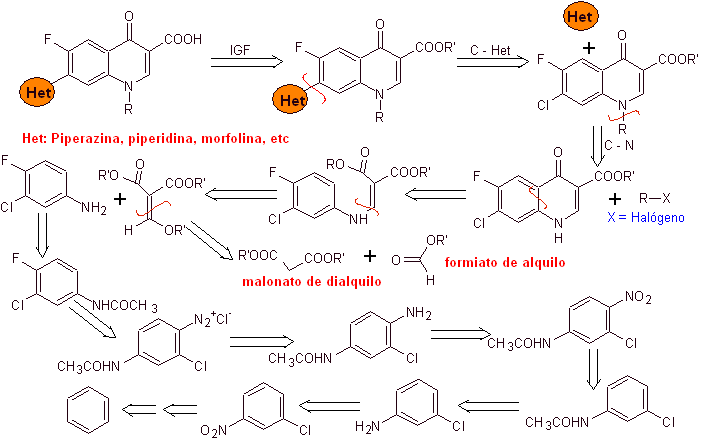
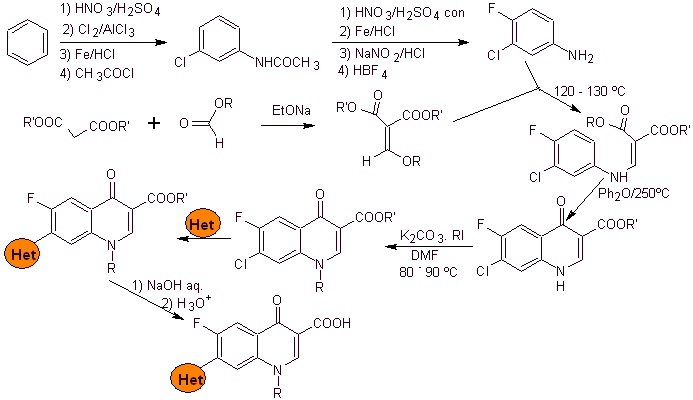
In den folgenden Jahren wurden Fluor in Position 6 und verschiedene Gruppen von Heterocyclen in Position 7 in den Basisring von Benzochinolonen eingeführt, wodurch Fluorchinolone mit einem größeren antibakteriellen Spektrum entstanden.
Wichtige Teile der in diesen Synthesen verwendeten Methoden wurden von Leyva S und Leyva E zusammengestellt in sehr guter Arbeit aus biochemischer Sicht.
Die auf den Bericht der untersuchten Synthesen angewendete Trennungsmethode und die Reaktionen der ersten Stufen der Synthesen liegen in der alleinigen Verantwortung des Autors dieser Monographie. .
i) Synthese berichtet von Koga H. et al.
Retrosynthetische Analyse:
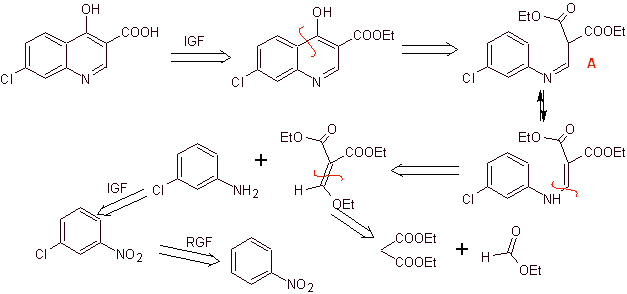
Synthese: Es bildet ausgehend von Benzol 3-Chlor-4-fluoranilin, das mit Diethyl-EMME zum entsprechenden Acrylat reagiert, das beim Erhitzen eine zyklische Verbindung bildet. Diese Verbindung wird wiederum mit einem Alkylierungsmittel umgesetzt und anschließend wird die stickstoffhaltige heterocyclische Verbindung eingeführt, um schließlich zu hydrolysieren und das Zielmolekül zu erhalten.
Retrosynthetische Analyse:
Synthese: Ausgehend von Benzol, um 3-Chloranilin mit Diethylethoxymethylenmalonat (EMMET), gebildet aus der Kondensation von Ethylformiat und Diethylmalonat in einem basischen Medium, zu bilden, um Verbindung A herzustellen, die anschließend in Gegenwart eines Diphenylethers erhitzt wird, um zu erzeugen die cyclische Chinolinverbindung, die leicht zu der entsprechenden Säure hydrolysiert wird.
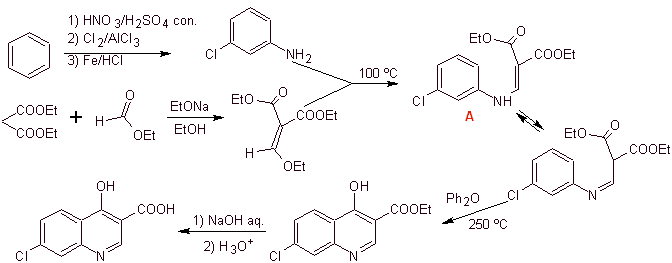
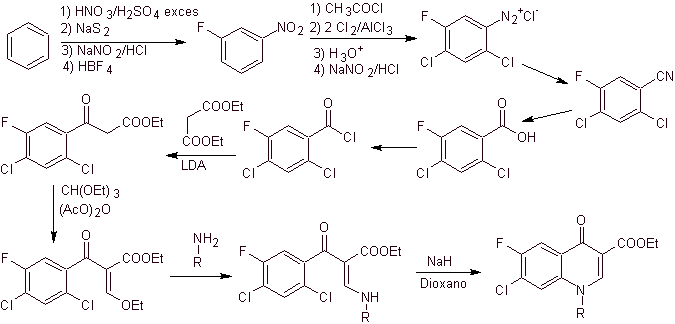
iii) Synthese berichtet von Grohe und Zeiler
Retrosynthetische Analyse: Die CN-Bindung beginnt zu trennen und das Amin wird weiterhin getrennt, um die 1,3-diCO-Verbindung zu erreichen, die als solche getrennt werden könnte, aber die von ihren Autoren vorgeschlagene Reaktion wird respektiert und Diethylmalonat wird als erzeugt Zwischenprodukt sowie das mehrfachhalogenierte Derivat von Benzoylchlorid.
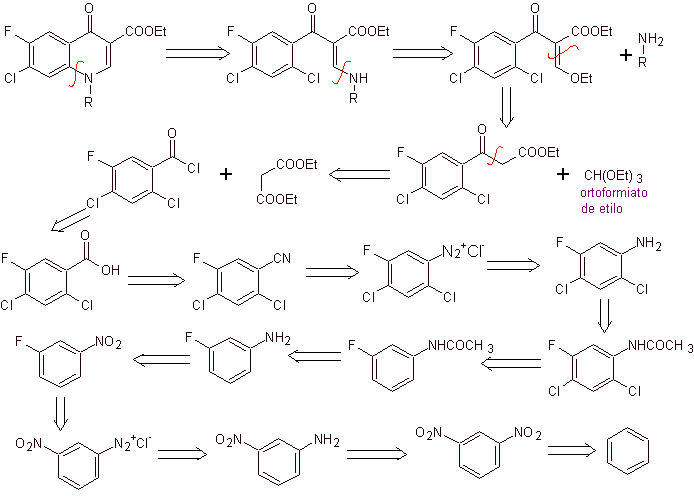
Synthese. Aus Benzol kann Ethylbenzoylacetat erhalten werden, das an den entsprechenden Positionen mit Fluor und Chlor substituiert ist. Diese Verbindung wird mit Triethylorthoformiat umgesetzt, um das entsprechende Ethoxyalken herzustellen, wobei es möglich ist, die Ethoxygruppe durch eine Aminogruppe zu ersetzen, um das entsprechende Amin herzustellen, das mit einer starken Base zum Fluorchinolon cyclisiert wird. wie man sieht Fluor, Chlor oder Nitro nehmen als mögliche Abgangsgruppen an der Cyclisierungsreaktion teil. Dieses Verfahren war sehr vielseitig und wurde bei der Synthese von N-Aryl verwendet und N-Alkyl Fluorchinolone.
iv) Zusammenfassung von Grohe und Heitzer
Retrosynthetische Analyse .
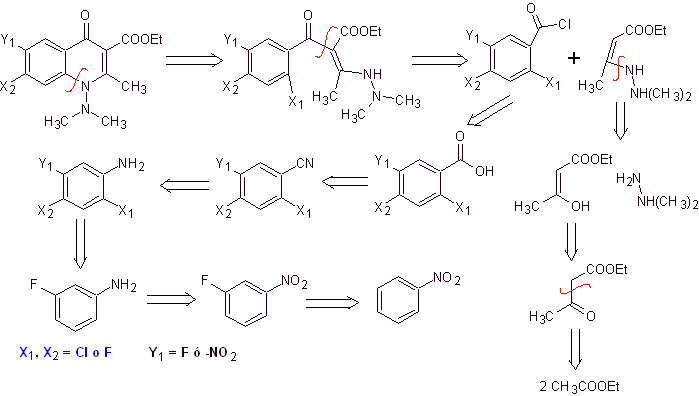
Synthese. Ein konvergenter Syntheseweg wird vorgeschlagen. Eines davon geht von der Claisen-Kondensation von zwei Mol Ethylacetat aus, um Ethylacetoacetat herzustellen, das mit dem methylierten Derivat von Hydrazin kombiniert wird, das das vinyloge Diamin bildet, das in der Reaktion mit dem Derivat von Benzoylchlorid verwendet wird, gebildet aus Nitrobenzol aufgrund der katalytischen Wirkung eines tertiären Amins.
Die gebildete Verbindung wird durch die Katalyse von DBU (1,8-Diazabicil[5.4.0]undec-7-en) cyclisiert, um ein Fluorchinolon herzustellen.
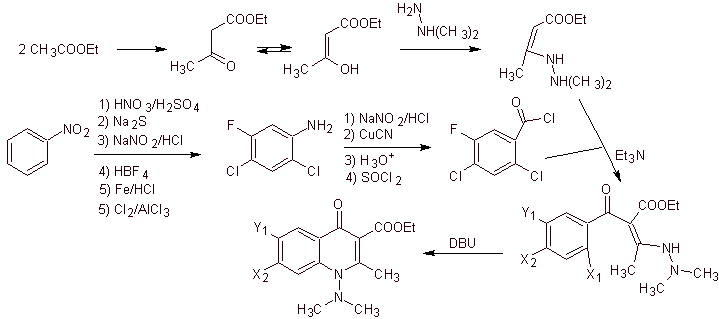
v) Synthese berichtet von Torii et al.
Retrosynthetische Analyse. Torii und seine Mitarbeiter berichteten 1990 über die Synthese fluorierter Chinolone durch einen carbonylierenden Cyclisierungsprozess, der durch Pd katalysiert wurde. Dieses Verfahren eignet sich sehr gut für die Synthese von Fluorchinolonen, die in Position 2 substituiert sind (R = –Me, -CH 2 COOMe, –COOMe). Eine retrosynthetische Analyse dieser Methode beginnt mit der Trennung an der Acylbindung und dem Vorschlag eines Organocadmiums als Vorläufermolekül oder synthetisches Äquivalent. Der Rest der Trennungen führt zu mehrfach substituiertem Anilin. mit Halogenen wie folgt:
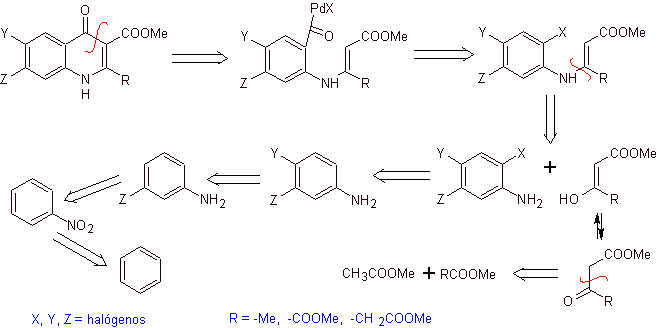
Synthese. Das Synthesedesign kann erneut durch einen konvergenten Weg skizziert werden. Der erste Weg bezieht sich auf die Bildung von Ethylacetoacetat und der zweite ausgehend von Benzol zu mehrfach halogeniertem Anilin, das unter katalytischen Karbonisierungsbedingungen in Gegenwart von Palladium cyclisiert. Ein abschließendes Erhitzen des Systems ermöglicht die Cyclisierung und Bildung des Fluorchinolons.
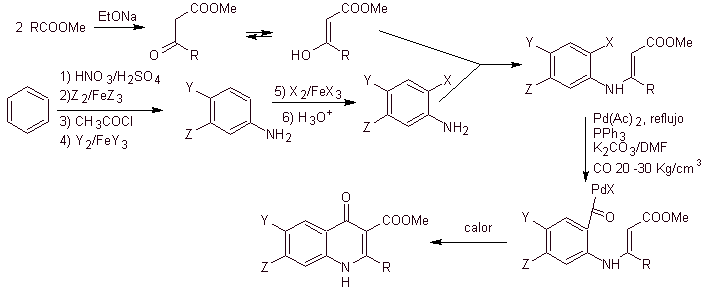
vi) Synthese, berichtet von Miyamoto et al.
Retrosynthetische Analyse:
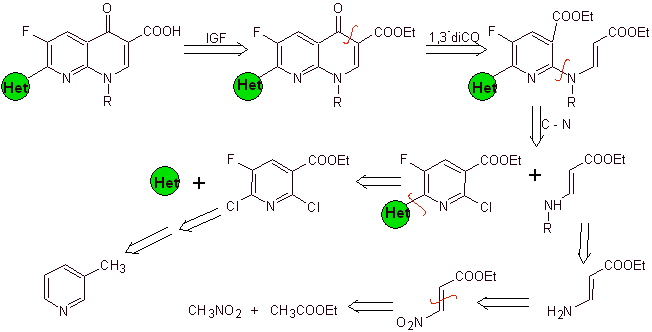
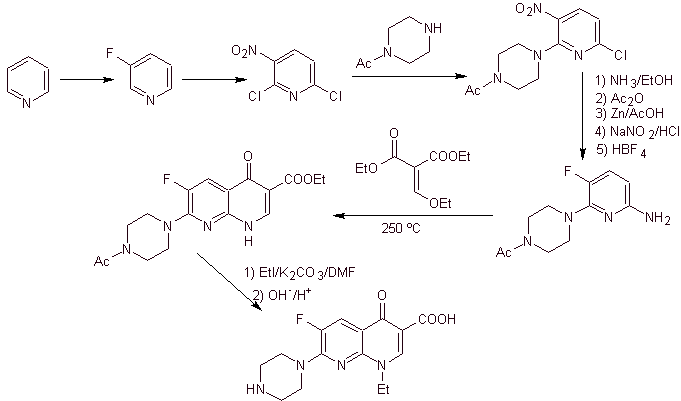
Synthese. Da die Halogene an den Positionen 2 und 6 von Pyridin hochreaktiv sind, ist es möglich, Chinolone nach dem von Miyamoto et al. gezeigten Verfahren herzustellen, bei dem der 2,6-Dichlorpyridinester mit einem cyclischen Amin umgesetzt wird, um ein zu ergeben Zwischenprodukt, das mit dem Vinylamin umgesetzt wird, um dann in einem basischen Medium zu cyclisieren. Hydrolysiert wird der Ester gebildet
das Fluorchinolon.
In jedem Fall erfolgt die Bildung des halogenierten Esters an den Positionen 2, 6 mit Chlor und F in 5. Es ist der kritische Teil dieser Synthese. Der mehrfach halogenierte Pyridinester kann aus 3-Methylpyridin (beta-Picolin) hergestellt werden, das aus der Destillation von Steinkohlenteer gewonnen wird.
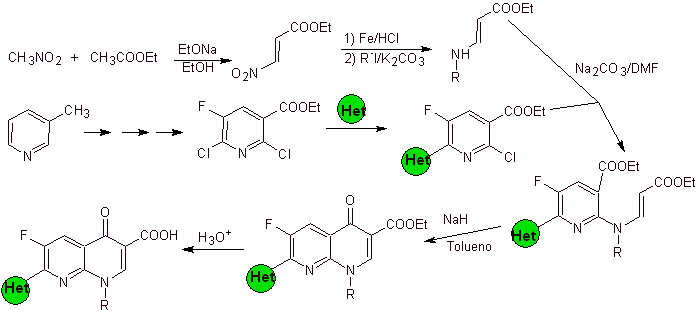
vii) Synthese, berichtet von Hayakawa
Retrosynthetische Analyse: Verbindungen wie Flumequin und Ofloxacin haben eine tricyclische Struktur. Ihre Synthese erfolgt nach Hayakawa et al. ausgehend von einer Struktur, die bereits den stickstoffhaltigen heterocyclischen Ring enthält.
Folglich beginnt die Aufspaltung durch die CO-Bindung, die aus der Acylierung des Benzolrings resultiert, und die CN-Aufspaltung setzt sich fort, was eine bicyclische Struktur und EMME (Diethylethoxymethylenmalonat) als synthetische Äquivalente hinterlässt. Die Kontinuität der Trennung hängt von der Natur von X (-CH 3 , O, S). wenn es sich um O oder S handelt, kann die Trennung wie angegeben gleichzeitig erfolgen. Die folgenden Operationen sind IGFs, die einen Blick auf Benzol als Ausgangsmaterial werfen.
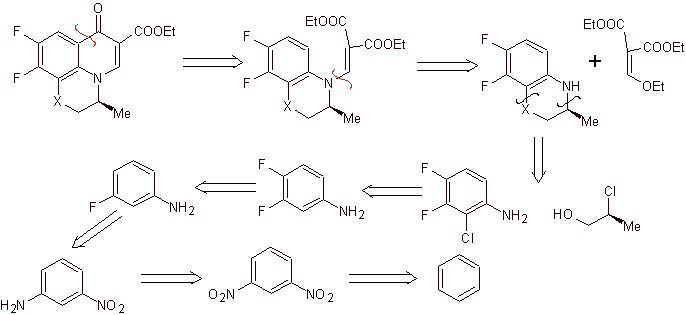
Synthese. Sandmeyer-Reaktionen können geeignet kombiniert werden, um F einzuführen und strukturelle Bedingungen für die Einführung von Chlor zu schaffen. Die Bildung des Heterocyclus kann mit 2-Chlorpropanol erfolgen, gebildet aus der Öffnung eines geeigneten Epoxids. Der Rest der Reaktionen, die die Verwendung von EMME beinhalten, sind bereits durch die Verfahren bekannt, die zuvor für die Synthese von Fluorchinolonen gesehen wurden.
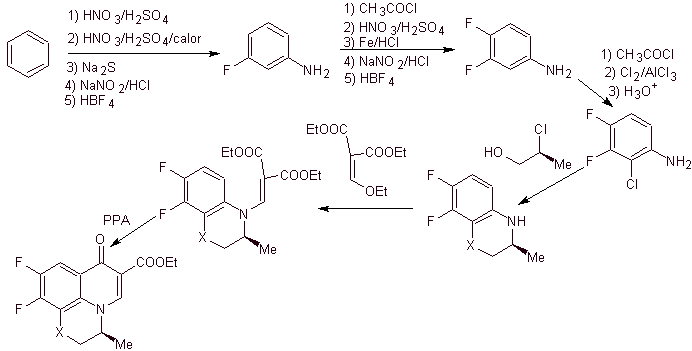
viii) Synthese, berichtet von Egawa et al.
Retrosynthetische Analyse . Die tricyclische Verbindung beginnt, durch die C-O-Bindung getrennt zu werden, ein Aspekt, der uns erkennen lässt, dass diese Bindung das Ergebnis einer intramolekularen Cyclisierung einer –OH-Verbindung mit dem F von Benzol war. Eine zweite CN-Trennung erzeugt ein EMME-Aminovorläufermolekül. Die folgenden Unterbrechungen sind allgemein bekannt.
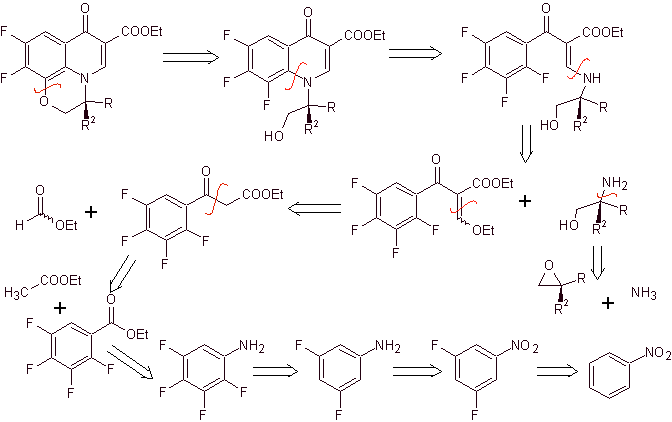
Synthese. Die erschöpfende Fluoridierung durch indirekte Methoden von Benzol wird erreicht, indem man zuerst Nitrobenzol als Ausgangsmaterial verwendet und es dann in ein Amin oder Amid umwandelt, um die anderen Positionen zu besetzen.
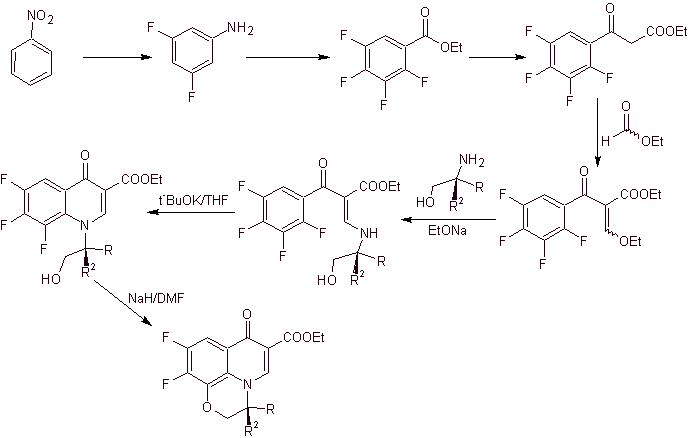
ix) Synthese, berichtet von Matsumoto et al.
Retrosynthetische Analyse.
Synthese: In dem von Matsumoto et al. die Gould-Jacobs-Reaktion wurde wieder verwendet; ausgehend von einem dichlorierten Nitropyridin wurden die Zwischenstufen zunächst mit synthetisiert
Der dritte Zyklus wird unter Verwendung von EMME und Alkylierung des Amins mit Ethyliodid erreicht, wobei schließlich die Amid- und Estergruppen hydrolysiert werden.
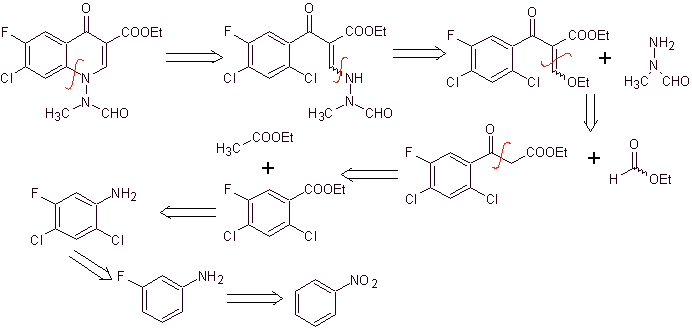
X) Synthese, berichtet von Chu et al.
Retrosynthetische Analyse: Sie beginnt mit der Spaltung der CN-Bindung des Heterocyclus und setzt sich mit dem CN des vinylogen Amins fort. In EMME wird es durch die Doppelbindung getrennt, um Ethylformiat als Vorläufermolekül zu erzeugen, die nächste Trennung ist vom 1,3-diCO-Typ, die uns mit der Claisen-Kondensation verbinden wird.Dann wird der resultierende aromatische Ester unterzogen verschiedene IGFs, bis Nitrobenzol als Ausgangsmaterial erreicht wird
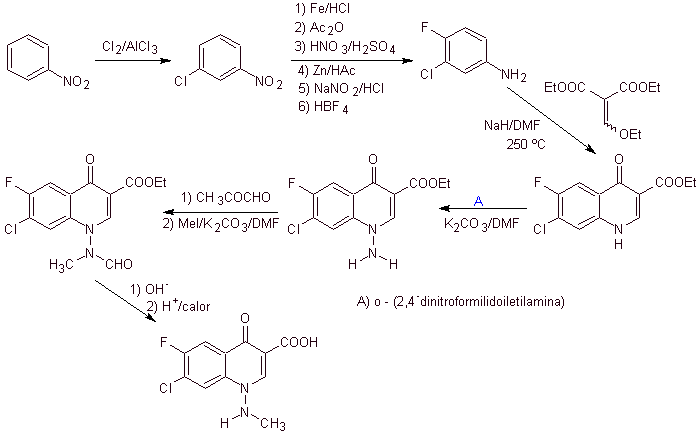
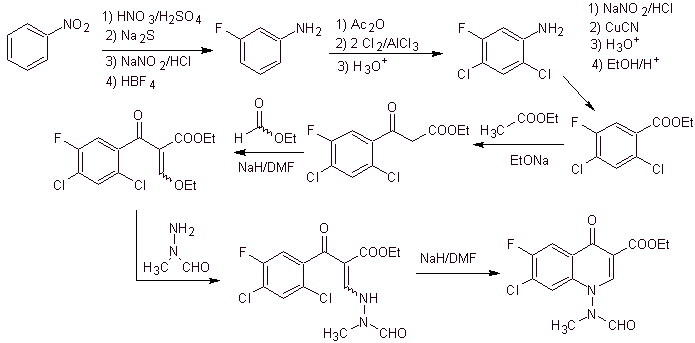
Synthese. Man kann von Nitrobenzol ausgehen und mit den notwendigen Reaktionen zu den geeignet mit F und Cl substituierten Ethylbenzoati gelangen, von denen die Claisen-Kondensation verwendet wird, gefolgt von einer weiteren Knoevenagel-Kondensation mit Ethylformiat. Dieses Zwischenprodukt wird dann mit N-Formyl-N-methylhydrazin umgesetzt und durch die Zugabe von NaH wird eine Cyclisierung erreicht, um zu der Endverbindung zu gelangen.
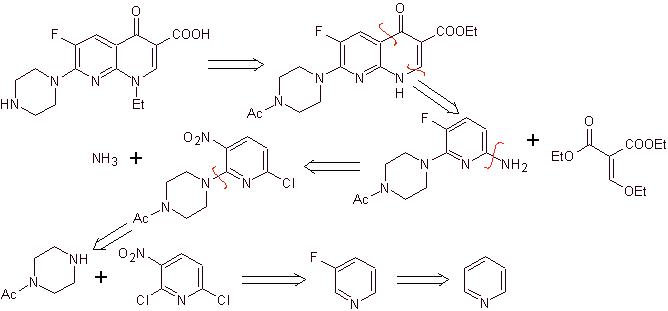
xi) Synthese, berichtet von Wenthand et al.
Retrosynthetische Analyse Chinolone mit einer substituierten Aminogruppe an Position 1, wie Amifloxacin, können nach der von Wentland beschriebenen Methodik synthetisiert werden. Aus diesem Grund werden Verbindungsabbrüche vom N-C-Link initiiert. und dann geht es weiter mit der NN-Bindung und dem Ringschluss, es folgt die Gould-Jacobs-Reaktion.
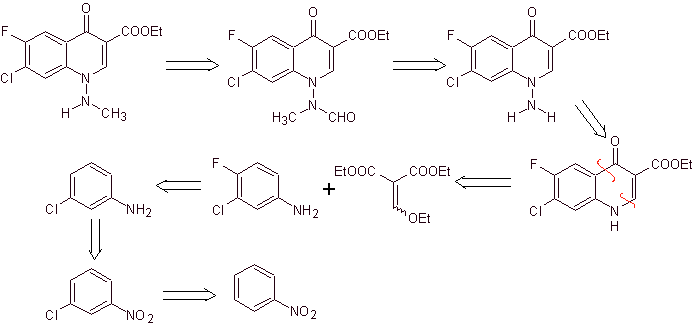
Synthese . Dabei wird die Aminogruppe des Chinolons mit einem Reagenz umgesetzt, das eine weitere Aminogruppe überträgt, die anschließend in ein Formamid-Derivat umgewandelt wird, um es später in die Verbindung 1-(N-Methyl)-7-Chlor - 6-Fluor-1,4-dihydro-4-oxo-chinolin-3-carbonsäure.