Синтез фторхинолоновых антибиотиков
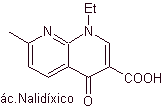
Хинолоны относятся к группе синтетических антибактериальных средств. Самый старый агент в этом семействе, налидиксовая кислота, применявшаяся в начале 1960-х годов, имеет хороший спектр против энтеробактерий (ограниченный антибактериальный спектр), но ее фармакокинетика не очень благоприятна для рутинного клинического применения из-за ее низкой биодоступности в тканях и ее короткой половины. -жизнь.
По этой причине необходимо было синтезировать новые антибактериальные препараты этого семейства для улучшения спектра действия, фармакокинетического профиля, снижения побочных эффектов и появления бактериальной резистентности. Эта новая группа представляет собой так называемые фторхинолоны, созданные в 80-х годах.
|
Многие исследователи сходятся во мнении, что реакция Гулда-Джейкобса , является основной основой для синтеза первых хинолонов для фармакологического применения, который произошел в 1960-х годах, эта реакция представляет собой следующую последовательность:
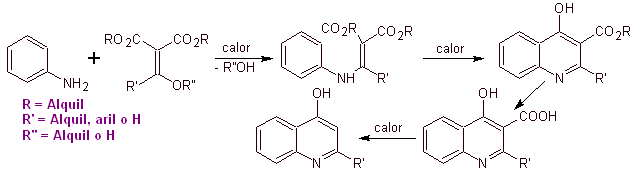
В последующие годы фтор в положении 6 и различные группы гетероциклов в положении 7 были введены в основное кольцо бензохинолонов, что привело к появлению фторхинолонов с более широким антибактериальным спектром.
Важные части методологий, используемых в этих синтезах, были собраны Лейвой С. и Лейвой Э. в очень хорошей работе с биохимической точки зрения.
Метод отключения, примененный к отчету об изучаемых синтезах, и реакции первых стадий синтезов являются исключительной ответственностью автора этой монографии. .
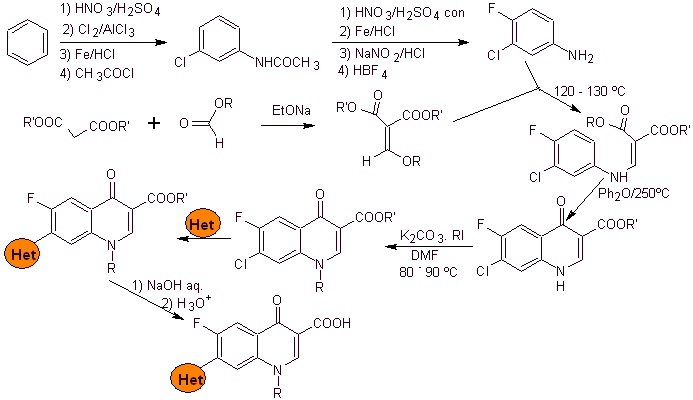
i) Синтез, описанный Koga H. et al.
Ретросинтетический анализ:
Синтез: Начинается с бензола с образованием 3-хлор-4-фторанилина, который реагирует с диэтиловым ЭММЕ с образованием соответствующего акрилата, который при нагревании образует циклическое соединение. Это соединение, в свою очередь, вводят в реакцию с алкилирующим агентом, а затем вводят азотсодержащее гетероциклическое соединение для окончательного гидролиза и получения целевой молекулы.
Ретросинтетический анализ:
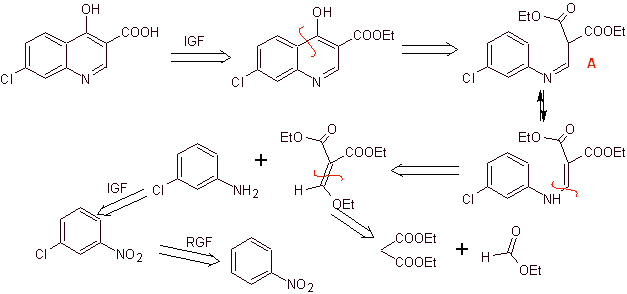
Синтез: исходя из бензола, с образованием 3-хлоранилина с диэтилэтоксиметиленмалонатом (EMMET), образованным в результате конденсации этилформиата и диэтилмалоната в щелочной среде, с получением соединения А, которое затем нагревают в присутствии дифенилового эфира для получения хинолиновое циклическое соединение, которое легко гидролизуется до соответствующей кислоты.
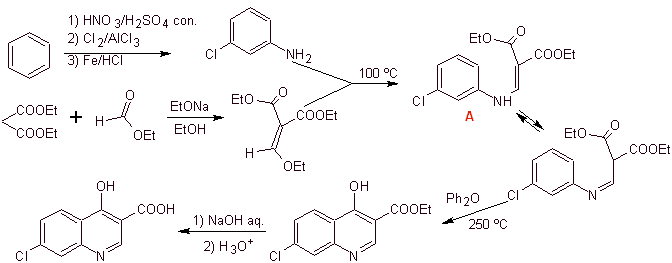
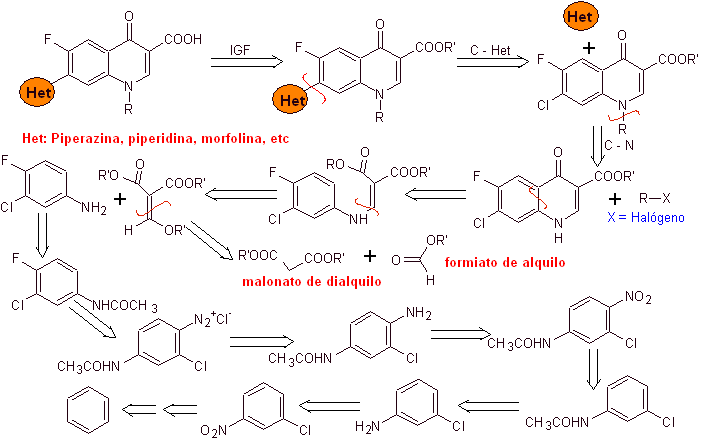
iii) Синтез, о котором сообщают Grohe и Zeiler
Ретросинтетический анализ: связь CN начинает разъединяться, а амин продолжает разъединяться, чтобы достичь соединения 1,3-диСО, которое могло бы быть разъединено как таковое, но реакция, предложенная ее авторами, соблюдается, и диэтилмалонат образуется как промежуточное, а также мультигалогенированное производное бензоилхлорида.
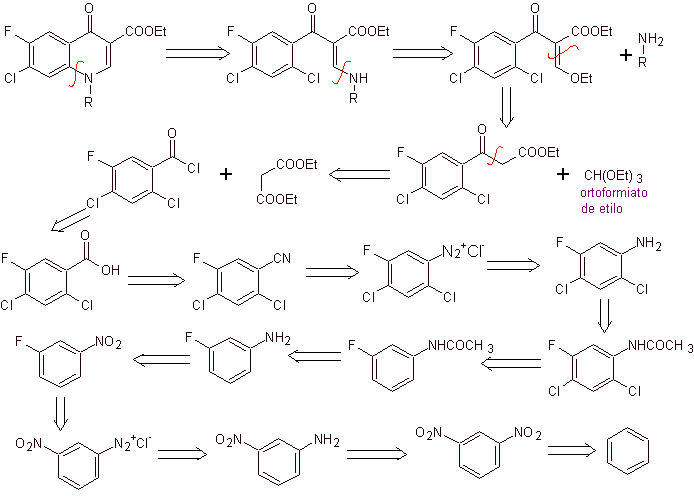
Синтез. Из бензола можно получить этилбензоилацетат, замещенный фтором и хлором в соответствующих положениях. Это соединение реагирует с триэтилортоформиатом с получением соответствующего этоксиалкена, где можно заменить этоксигруппу на аминогруппу с получением соответствующего амина, который циклизуют с сильным основанием до фторхинолона. как можно видеть фтор, хлор или нитро участвуют в реакции циклизации в качестве возможных уходящих групп. Этот метод был очень универсальным и использовался в синтезе N-арила. и N-алкил фторхинолоны.
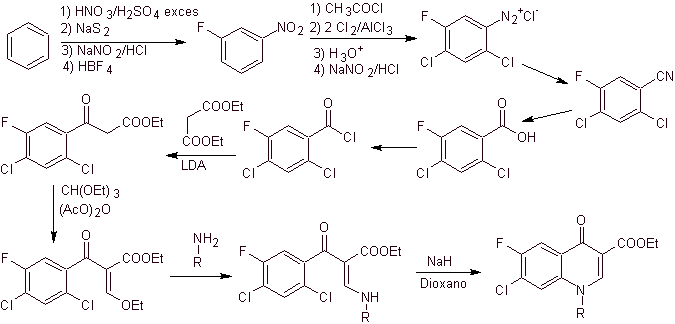
iv) Резюме, представленное Grohe и Heitzer
Ретросинтетический анализ .
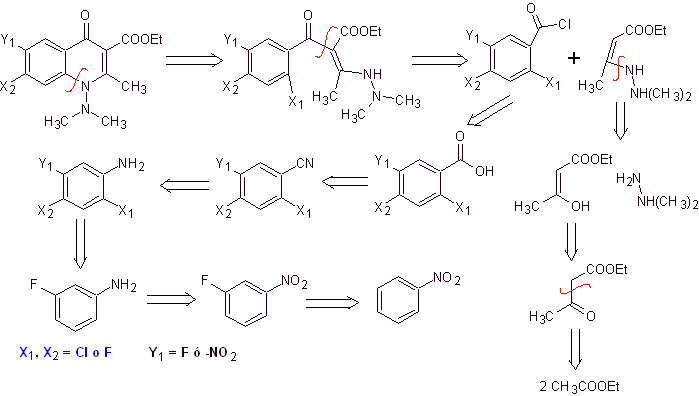
Синтез. Предложен конвергентный путь синтеза. Один из них начинается с конденсации Кляйзена двух молей этилацетата с получением этилацетоацетата, который соединяется с метилированным производным гидразина, образуя винилологический диамин, который будет использоваться в реакции с производным бензоилхлорида. образуется из нитробензола в результате каталитического действия третичного амина.
Образовавшееся соединение циклизуют с помощью катализа DBU (1,8-диазабицил[5.4.0]ундец-7-ен) с получением фторхинолона.
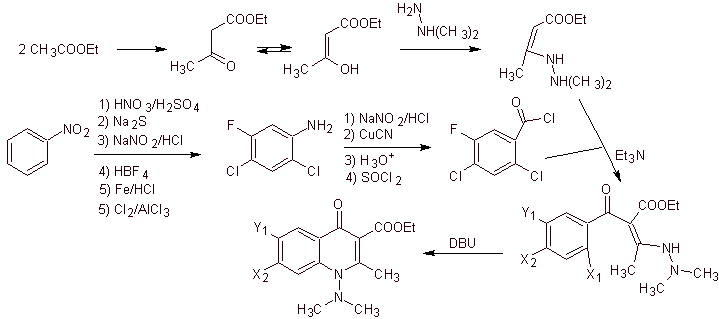
v) Синтез, описанный Torii et al.
Ретросинтетический анализ. Тори и его сотрудники в 1990 году сообщили о синтезе фторированных хинолонов с помощью процесса карбонилирующей циклизации, катализируемого Pd. Этот метод очень удобен для синтеза фторхинолонов, замещенных в положении 2 (R = –Me, -CH 2 COOMe, –COOMe). Ретросинтетический анализ этого метода начинается с разрыва ацильной связи и предложения кадмийорганического соединения в качестве молекулы-предшественника или синтетического эквивалента. Остальные разъединения приводят к многозамещенному анилину. с галогенами следующим образом:
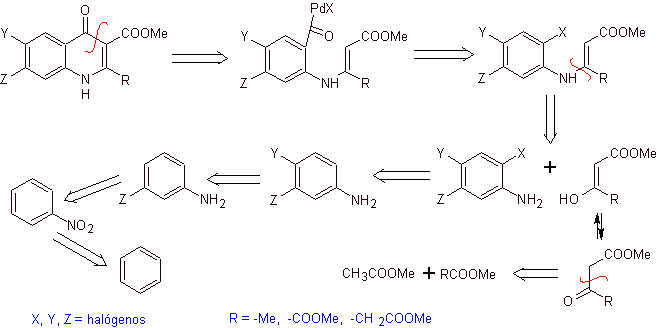
Синтез. Схема синтеза может быть снова нарисована по сходящемуся маршруту. Первый путь относится к образованию этилацетоацетата, а второй – от бензола до мультигалогенированного анилина, который циклизуется в условиях каталитической карбонизации в присутствии палладия. Окончательный нагрев системы позволяет провести циклизацию и образование фторхинолона.
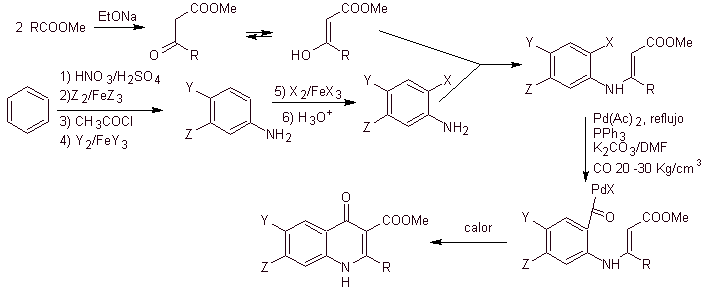
vi) Синтез, описанный Miyamoto et al.
Ретросинтетический анализ:
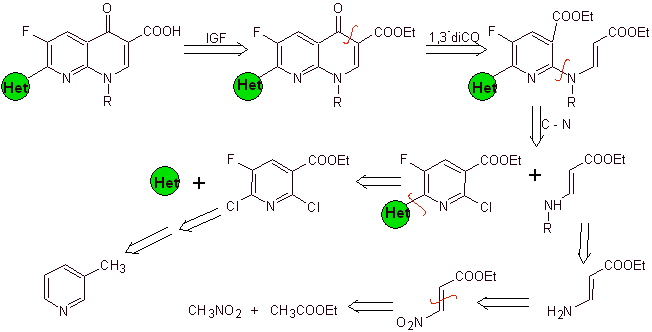
Синтез. Поскольку галогены в положениях 2 и 6 пиридина обладают высокой реакционной способностью, можно получить хинолоны по методике, показанной Miyamoto et al., в которой 2,6-дихлорпиридиновый эфир взаимодействует с циклическим амином с образованием промежуточное соединение, которое взаимодействует с виниламином с последующей циклизацией в щелочной среде. При гидролизе образуется сложный эфир
фторхинолон.
В любом случае образование галогенированного эфира в положениях 2, 6 с хлором и F в 5. Это критическая часть этого синтеза. Полигалогенированный пиридиновый эфир можно получить из 3-метилпиридина (бета-пиколина), который получают путем перегонки каменноугольной смолы.
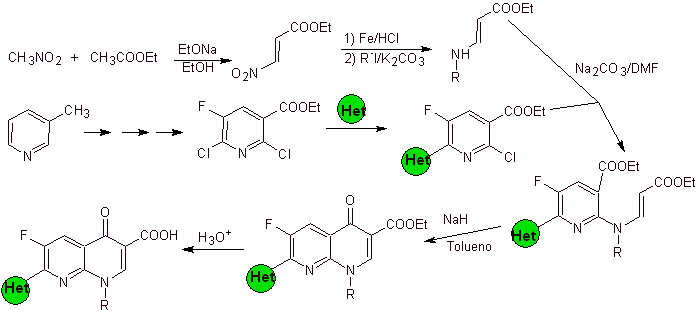
vii) Синтез, о котором сообщил Хаякава
Ретросинтетический анализ: такие соединения, как флумехин и офлоксацин, имеют трициклическую структуру. Их синтез осуществляют согласно Hayakawa et al., начиная со структуры, которая уже содержит азотсодержащее гетероциклическое кольцо.
Следовательно, начинается разъединение по связи СО, возникающее в результате ацилирования бензольного кольца, и продолжается разъединение CN, оставляя бициклическую структуру и ЭММЕ (диэтилэтоксиметиленмалонат) в качестве синтетических эквивалентов. Непрерывность отключения зависит от природы X (-CH 3 , ОПЕРАЦИОННЫЕ СИСТЕМЫ). в случае O или S отключение может быть одновременным, как указано. Следующие операции представляют собой IGF, которые позволяют увидеть бензол в качестве исходного материала.
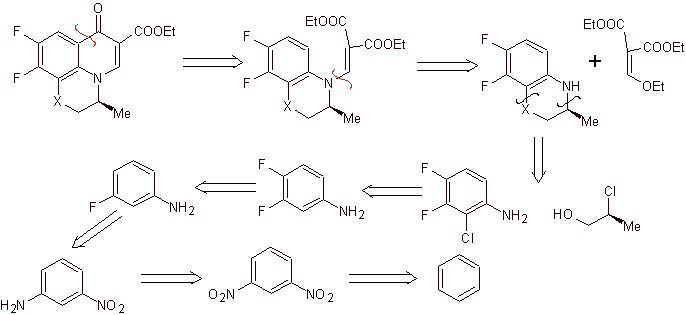
Синтез. Реакции Зандмейера можно надлежащим образом комбинировать для введения F и создания структурных условий для введения хлора. Образование гетероцикла можно проводить с 2-хлорпропанолом, образованным из раскрытого подходящего эпоксида. Остальные реакции, которые включают использование ЭММЕ, уже известны по методам, ранее применявшимся для синтеза фторхинолонов.
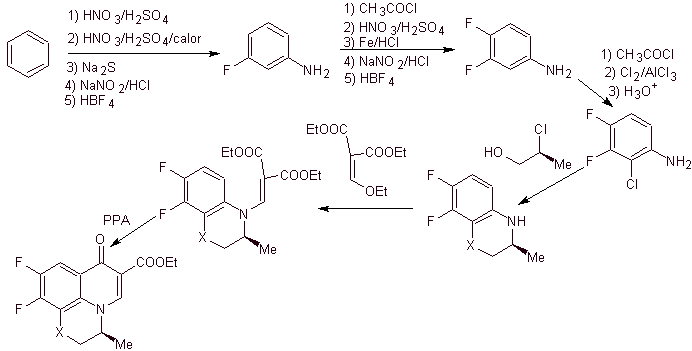
viii) Синтез, описанный Egawa et al.
Ретросинтетический анализ . Трициклическое соединение начинает разъединяться по связи С-О, что позволяет нам видеть, что эта связь была результатом внутримолекулярной циклизации соединения –ОН с F бензола. Второе разъединение CN генерирует молекулу-предшественник аминогруппы EMME. Следующие разъединения хорошо известны.
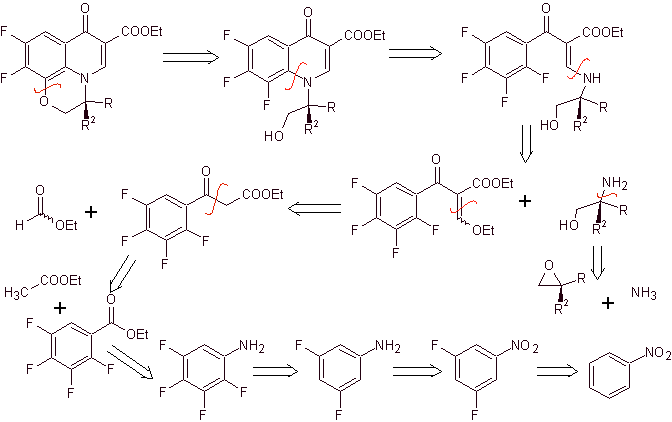
Синтез. Исчерпывающее фторирование бензола непрямыми методами достигается сначала с использованием нитробензола в качестве исходного материала, а затем превращением его в амин или амид, чтобы занять другие положения.
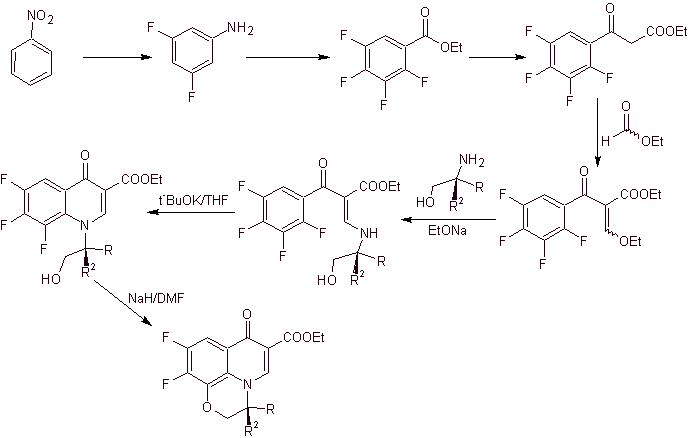
ix) Синтез, описанный Matsumoto et al.
Ретросинтетический анализ.
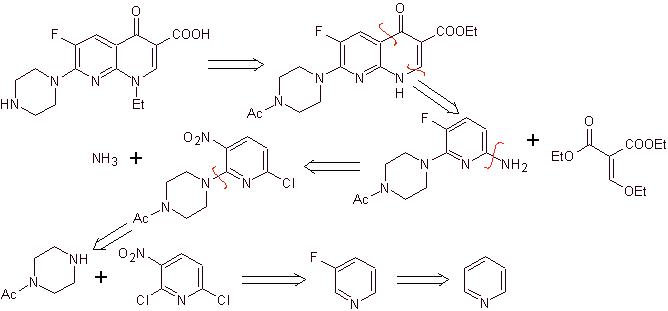
Синтез: в процедуре, описанной Matsumoto et al. снова использовали реакцию Гулда-Якобса; начиная с дихлорированного нитропиридина, были синтезированы промежуточные продукты, сначала с
Третий цикл достигается с использованием EMME и алкилирования амина этилиодидом, наконец, гидролизуя амидные и сложноэфирные группы.
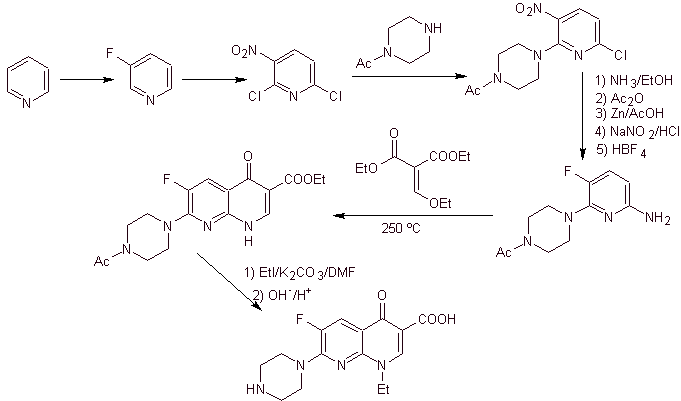
X) Синтез, описанный Chu et al.
Ретросинтетический анализ: он начинается с разрыва связи CN гетероцикла и продолжается с CN винилогенного амина. В EMME он разъединяется двойной связью с образованием этилформиата в качестве молекулы-предшественника, следующее разъединение имеет тип 1,3-диСО, что свяжет нас с конденсацией Клайзена, Затем полученный ароматический эфир подвергается различные IGF, пока не достигли нитробензола в качестве исходного материала
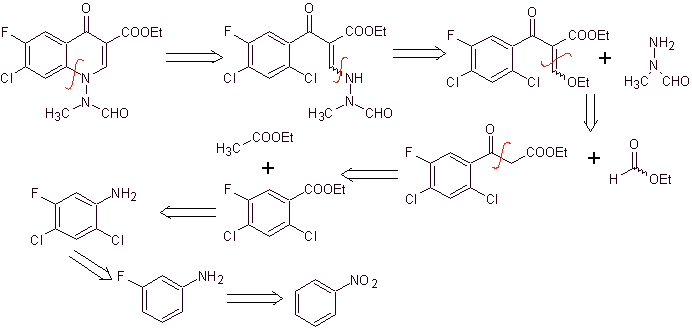
Синтез. Можно начать с нитробензола и с помощью необходимых реакций получить этилбензоат, подходящим образом замещенный F и Cl, из которого используют конденсацию Клайзена, а затем другую конденсацию Кнёвенагеля с этилформиатом. Это промежуточное соединение затем подвергают взаимодействию с N-формил-N-метилгидразином, и при добавлении NaH достигается циклизация с получением конечного соединения.
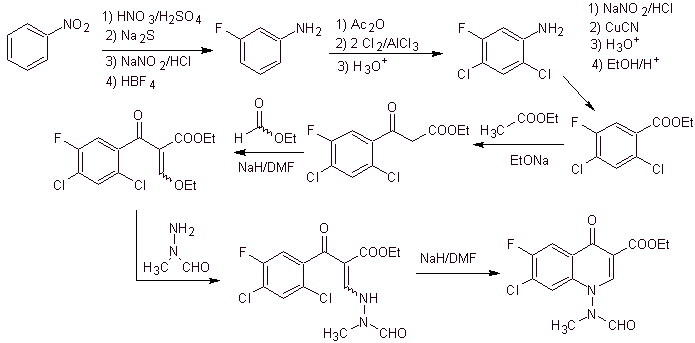
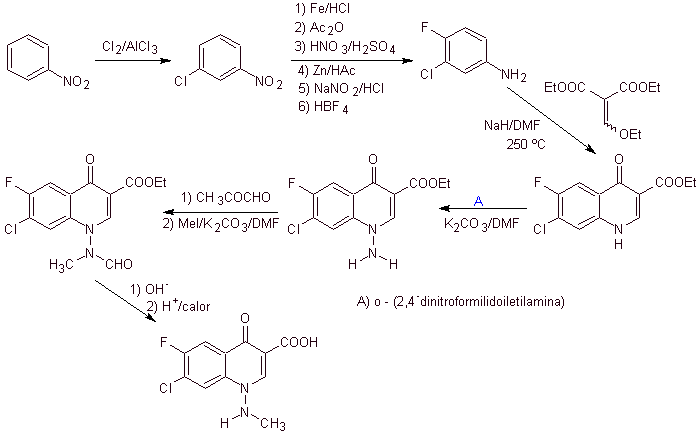
xi) Синтез, описанный Wenthand et al.
Ретросинтетический анализ. Хинолоны с замещенной аминогруппой в положении 1, такие как амифлоксацин, могут быть синтезированы в соответствии с методологией, описанной Wentland. По этой причине разъединения инициируются каналом N-C. а затем она продолжается связью NN и замыканием кольца, следует реакция Гулда-Джейкобса.
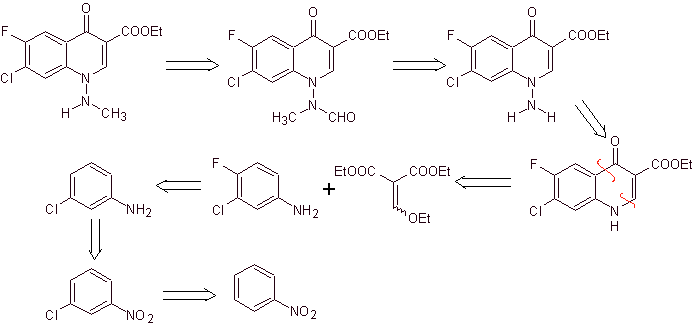
синтез . В этом случае аминогруппу хинолона вводят в реакцию с реагентом, переносящим другую аминогруппу, которую затем превращают в производное формамида, чтобы затем превратить в соединение 1-(N-метил)-7-хлор- 6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота.