Sintesis Antibiotik Fluoroquinolone
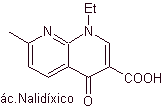
Kuinolon termasuk dalam kelompok agen antibakteri sintetik. Agen tertua dalam keluarga ini, asam nalidiksat, digunakan pada awal 1960-an, memiliki spektrum yang baik melawan enterobakteri (spektrum antibakteri terbatas) tetapi farmakokinetiknya tidak terlalu menguntungkan untuk penggunaan klinis rutin karena bioavailabilitasnya yang rendah. -kehidupan.
Untuk alasan ini, perlu untuk mensintesis antibakteri baru dari keluarga ini untuk meningkatkan spektrum aktivitas, profil farmakokinetik, mengurangi efek samping dan munculnya resistensi bakteri. Kelompok baru ini disebut fluoroquinolones, yang dihasilkan selama tahun 80-an.
|
Banyak peneliti setuju bahwa reaksi Gould-Jacobs , adalah dasar utama sintesis kuinolon pertama untuk penggunaan farmakologis, yang terjadi pada tahun 1960-an, reaksi ini menunjukkan urutan sebagai berikut:
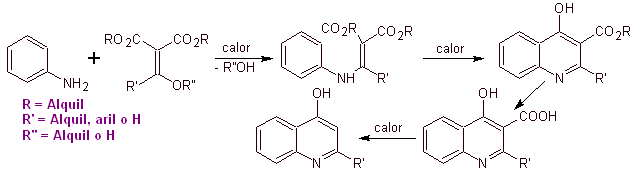
Pada tahun-tahun berikutnya, fluor pada posisi 6 dan berbagai kelompok heterosiklik pada posisi 7 telah dimasukkan ke dalam cincin dasar benzokuinolon, sehingga menimbulkan fluorokuinolon dengan spektrum antibakteri yang lebih besar.
Bagian penting dari metodologi yang digunakan dalam sintesis ini telah disusun oleh Leyva S dan Leyva E dalam pekerjaan yang sangat baik dari perspektif biokimia.
Metode pemutusan yang diterapkan pada laporan sintesis yang diteliti dan reaksi tahap pertama sintesis merupakan tanggung jawab penulis monograf ini. .
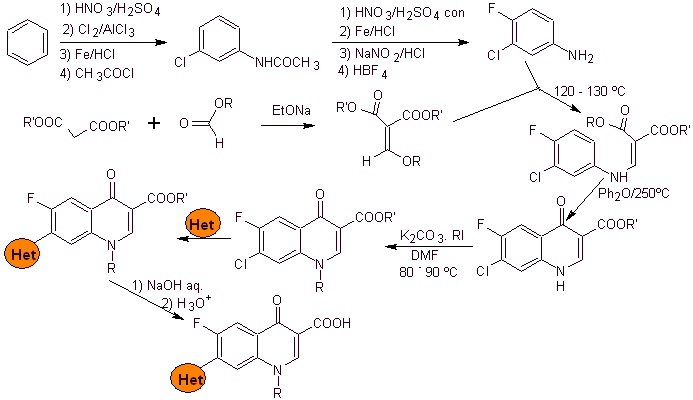
i) Sintesis dilaporkan oleh Koga H. et al.
Analisis retrosintetik:
Sintesis: Dimulai dari benzena untuk membentuk 3-kloro-4-fluoroanilin, yang bereaksi dengan dietil EMME untuk menghasilkan akrilat yang sesuai, yang bila dipanaskan membentuk senyawa siklik. Senyawa ini pada gilirannya direaksikan dengan zat alkilasi dan selanjutnya senyawa heterosiklik nitrogen dimasukkan, untuk akhirnya menghidrolisis dan mendapatkan molekul target.
Analisis retrosintetik:
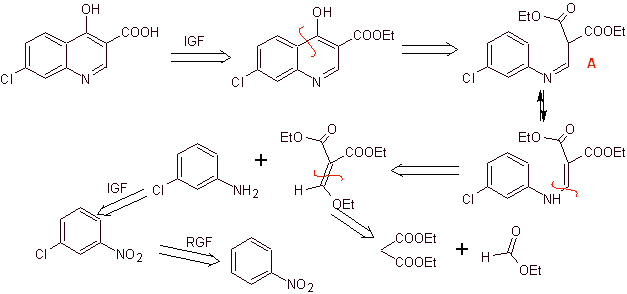
Sintesis: Berawal dari benzena, membentuk 3-kloroanilin dengan dietil etoksimetilenalonat (EMMET) yang terbentuk dari kondensasi etil format dan dietil malonat dalam medium basa, menghasilkan senyawa A, yang selanjutnya dipanaskan dengan adanya difenil eter untuk menghasilkan senyawa siklik quinoline, yang mudah dihidrolisis menjadi asam yang sesuai.
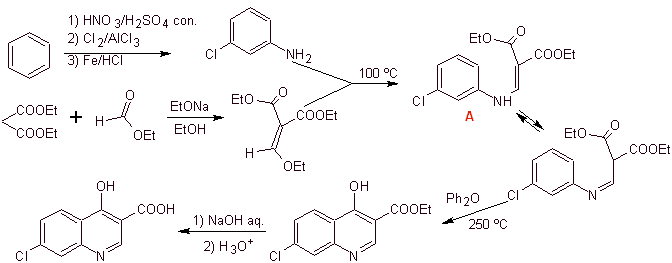
iii) Sintesis dilaporkan oleh Grohe dan Zeiler
Analisis retrosintetik: Ikatan CN mulai terputus dan amina terus terputus, untuk mencapai senyawa 1,3-diCO, yang dapat diputuskan seperti itu, tetapi reaksi yang diusulkan oleh penulisnya dihormati dan dietil malonat dihasilkan sebagai intermediet, serta turunan multihalogenasi dari benzoil klorida.
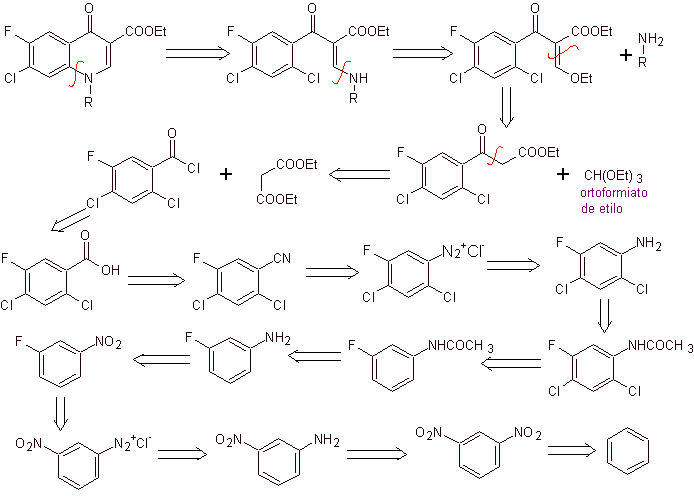
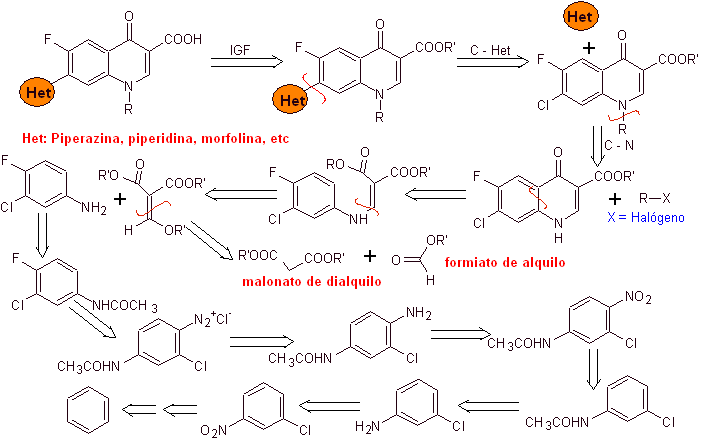
Perpaduan. Dari benzena , etil benzoil asetat dapat diperoleh disubstitusi dengan fluor dan klorin pada posisi yang sesuai. Senyawa ini direaksikan dengan trietil ortoformat untuk menghasilkan etoksialkena yang sesuai, di mana dimungkinkan untuk mengganti gugus etoksi dengan gugus amino untuk menghasilkan masing-masing amina, yang disiklisasi dengan basa kuat menjadi fluorokuinolon. seperti yang terlihat fluorin, klorin atau nitro berpartisipasi mungkin meninggalkan kelompok dalam reaksi siklisasi. Metode ini sangat serbaguna, dan telah digunakan dalam sintesis N-aril dan N-alkil fluorokuinolon.
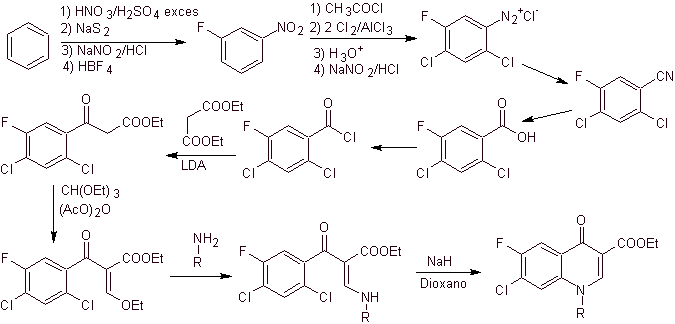
iv) Ringkasan yang dilaporkan oleh Grohe dan Heitzer
Analisis retrosintetik .
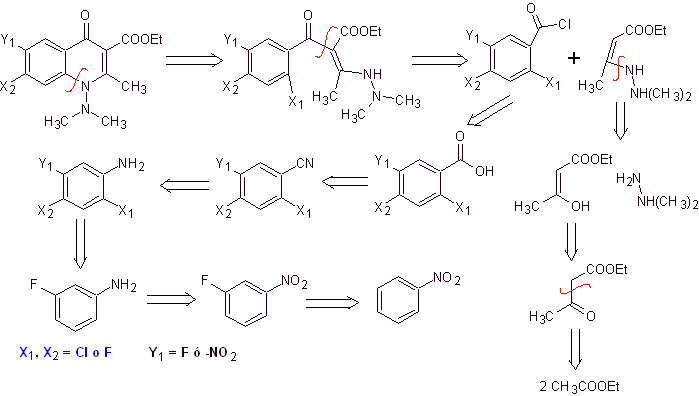
Perpaduan. Rute sintesis konvergen diusulkan. Salah satunya dimulai dari kondensasi Claisen dari dua mol etil asetat, untuk menghasilkan etil asetoasetat, yang digabungkan dengan turunan termetilasi dari hidrazin, yang membentuk diamina vinilog, yang akan digunakan dalam reaksi dengan turunan benzoil klorida, terbentuk dari nitrobenzena karena aksi katalitik dari amina tersier.
Senyawa yang terbentuk disikluskan dengan katalisis DBU (1,8-Diazabicil[5.4.0]undec-7-en), untuk menghasilkan fluoroquinolone.
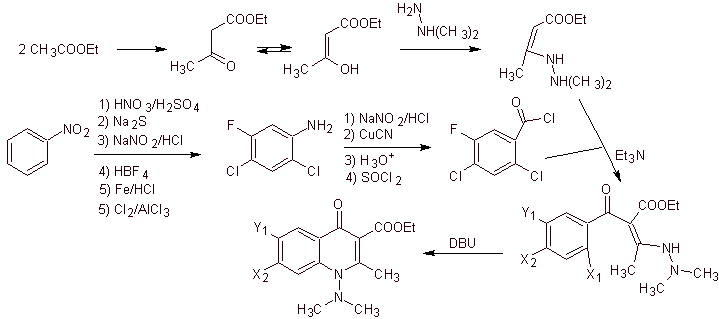
v) Sintesis dilaporkan oleh Torii et al.
Analisis retrosintetik. Torii dan kolaboratornya pada tahun 1990 telah melaporkan sintesis kuinolon terfluorinasi melalui proses siklisasi karbonilatif, yang dikatalisis oleh Pd. Metode ini sangat cocok untuk sintesis fluoroquinolones, disubstitusi pada posisi 2 (R = –Me, -CH 2 COOOMe, –COOMe). Analisis retrosintetik dari metode ini dimulai dengan memutuskan ikatan asil dan mengusulkan organokadmium sebagai molekul prekursor atau ekuivalen sintetik. Pemutusan sisa menyebabkan anilin multisubstitusi. dengan halogen, sebagai berikut:
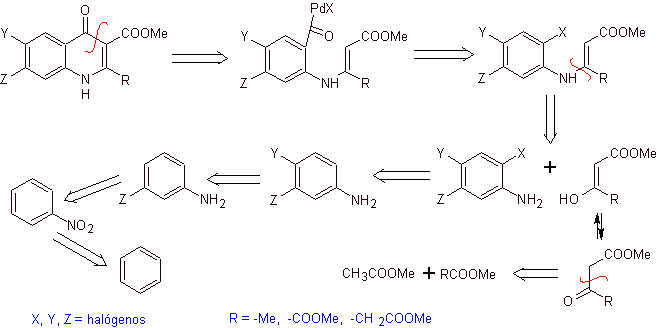
Perpaduan. Desain sintesis dapat disketsa kembali melalui rute konvergen. Rute pertama mengacu pada pembentukan etil asetoasetat dan yang kedua, dimulai dari benzena hingga anilin multihalogenasi, yang akan tersiklis dalam kondisi karbonisasi katalitik dengan adanya paladium. Pemanasan akhir sistem memungkinkan siklisasi dan pembentukan fluorokuinolon.
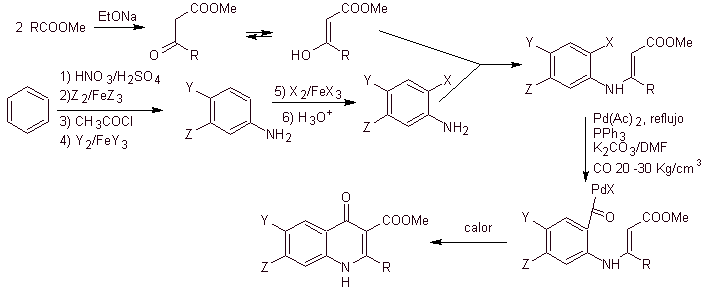
vi) Sintesis dilaporkan oleh Miyamoto et al.
Analisis retrosintetik:
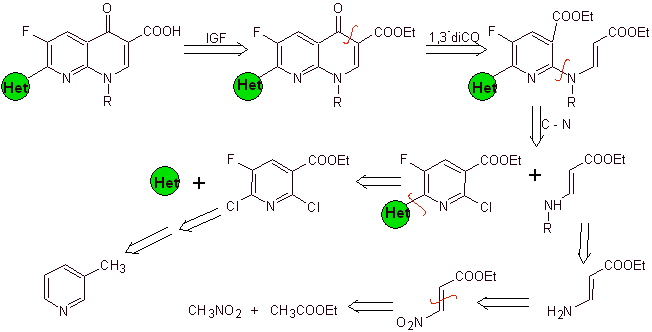
Perpaduan. Karena halogen pada posisi 2 dan 6 piridin sangat reaktif, dimungkinkan untuk menyiapkan kuinolon dengan prosedur yang ditunjukkan oleh Miyamoto et al, di mana ester 2,6-dikloropiridin direaksikan dengan amina siklik untuk menghasilkan perantara yang direaksikan dengan vinil amina, untuk kemudian disikliskan dalam media basa. Hidrolisis ester terbentuk
fluorokuinolon.
Bagaimanapun, pembentukan ester terhalogenasi pada posisi 2, 6 dengan klorin dan F dalam 5. Ini adalah bagian penting dari sintesis ini. Ester piridin multihalogenasi dapat dibuat dari 3-metilpiridin (beta-pikolin), yang diperoleh dari distilasi tar batubara.
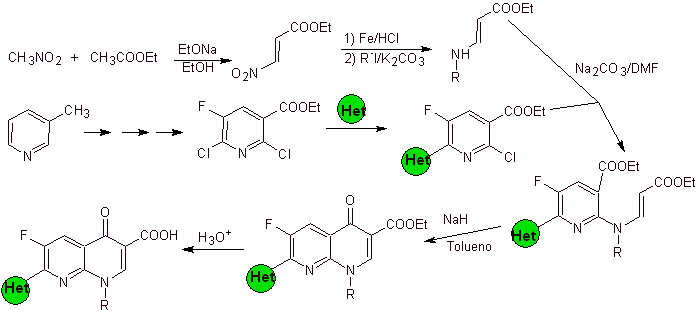
vii) Sintesis dilaporkan oleh Hayakawa
Analisis retrosintetik: Senyawa seperti flumequine dan ofloxacin memiliki struktur trisiklik. Sintesisnya dilakukan menurut Hayakawa et al., dimulai dari struktur yang sudah mengandung cincin heterosiklik nitrogen.
Akibatnya, pemutusan oleh ikatan CO dimulai, dihasilkan dari asilasi cincin benzena, dan pemutusan CN berlanjut, yang meninggalkan struktur bisiklik dan EMME (dietil etoksimetilena malonat) sebagai ekuivalen sintetik. Kontinuitas pemutusan bergantung pada sifat X (-CH 3 , O, S). dalam hal menjadi O atau S, pemutusan dapat dilakukan secara bersamaan seperti yang ditunjukkan. Operasi berikut adalah IGF yang memungkinkan sekilas benzena sebagai bahan awal.
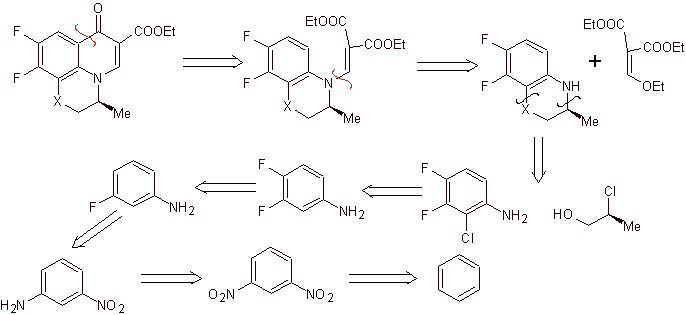
Perpaduan. Reaksi Sandmeyer dapat digabungkan dengan tepat untuk memperkenalkan F dan menciptakan kondisi struktural untuk memperkenalkan klorin. Pembentukan heterosiklik dapat dilakukan dengan 2-kloropropanol, yang terbentuk dari pembukaan epoksida yang sesuai. Reaksi lainnya yang termasuk penggunaan EMME sudah diketahui dengan metode yang sebelumnya terlihat untuk sintesis fluoroquinolones.
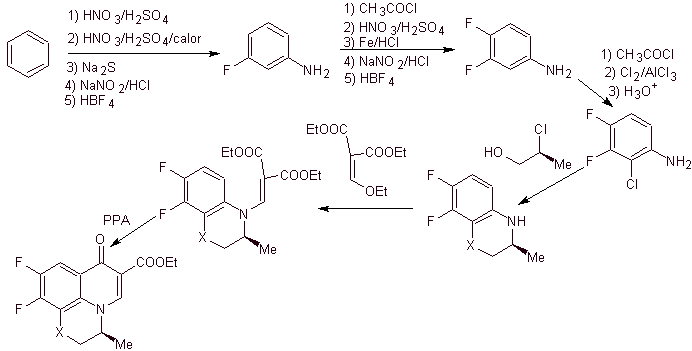
viii) Sintesis dilaporkan oleh Egawa et al.
Analisis retrosintetik . Senyawa trisiklik mulai dipisahkan oleh ikatan C-O, suatu aspek yang memungkinkan kita untuk melihat bahwa ikatan ini adalah hasil dari siklisasi intramolekul senyawa –OH dengan F benzena. Pemutusan CN kedua menghasilkan molekul prekursor amino EMME. Pemutusan hubungan berikut sudah diketahui dengan baik.
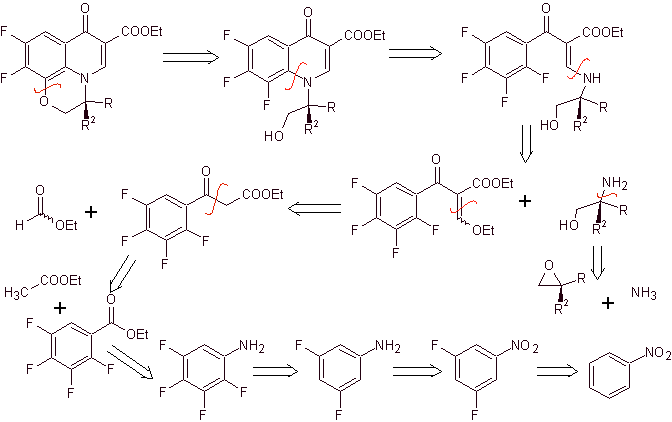
Perpaduan. Fluoridasi lengkap, dengan metode benzena tidak langsung, dicapai pertama kali dengan menggunakan nitrobenzena sebagai bahan awal, kemudian mengubahnya menjadi amina atau amida, untuk menempati posisi lainnya.
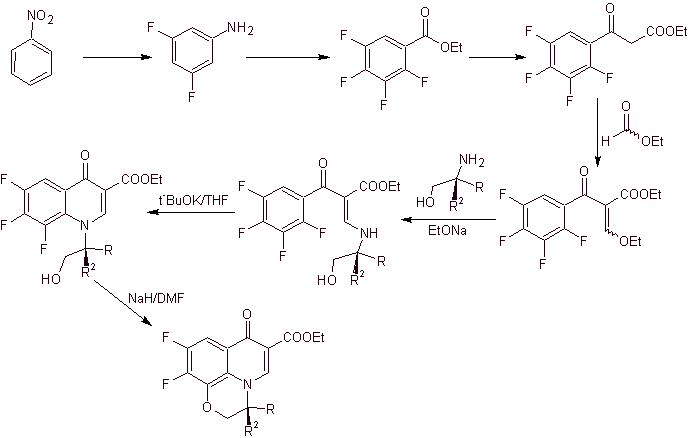
ix) Sintesis dilaporkan oleh Matsumoto et al.
Analisis retrosintetik.
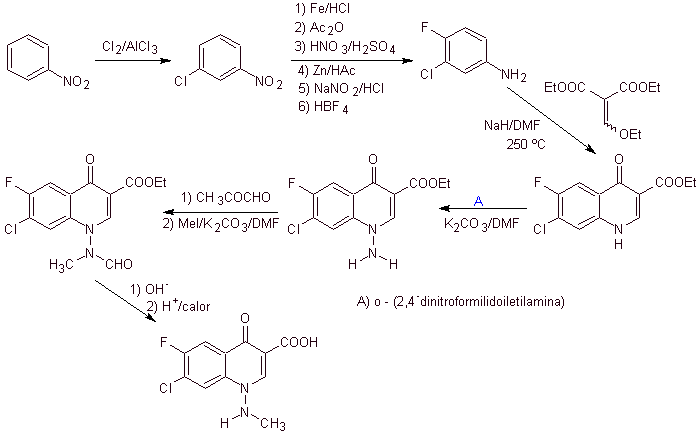
Sintesis: Dalam prosedur yang dilaporkan oleh Matsumoto et al. reaksi Gould-Jacob kembali digunakan; mulai dari nitropiridin diklorinasi, intermediet disintesis, pertama dengan
Siklus ketiga dicapai dengan menggunakan EMME dan mengalkilasi amina dengan etil iodida, akhirnya menghidrolisis gugus amida dan ester.
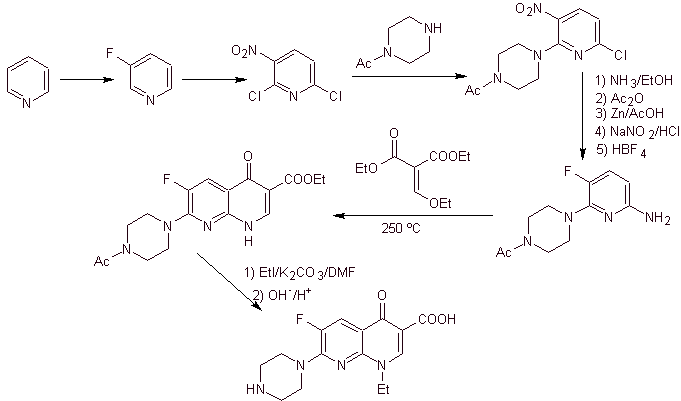
X) Sintesis dilaporkan oleh Chu et al.
Analisis retrosintetik: Ini dimulai dengan memutuskan ikatan CN dari heterocycle dan berlanjut dengan CN dari amina vinil. Dalam EMME, itu terputus oleh ikatan rangkap, untuk menghasilkan etil format sebagai molekul prekursor, pemutusan berikutnya adalah jenis 1,3-diCO, yang akan menghubungkan kita ke kondensasi Claisen.Kemudian ester aromatik yang dihasilkan mengalami berbagai IGFs, sampai mencapai nitrobenzene sebagai bahan awal
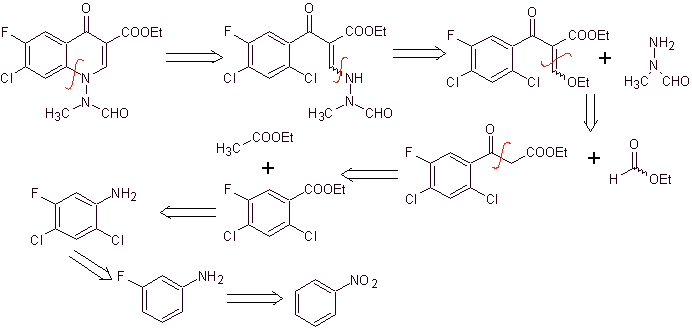
Perpaduan. Seseorang dapat mulai dari nitrobenzena, dan dengan reaksi yang diperlukan, mencapai etil benzoati yang sesuai disubstitusi dengan F dan Cl, dari mana kondensasi Claisen digunakan diikuti oleh kondensasi Knoevenagel lainnya dengan etil format. Zat antara ini kemudian direaksikan dengan N-formil-N-metilhidrazin dan dengan penambahan NaH, siklisasi dicapai untuk sampai pada senyawa akhir.
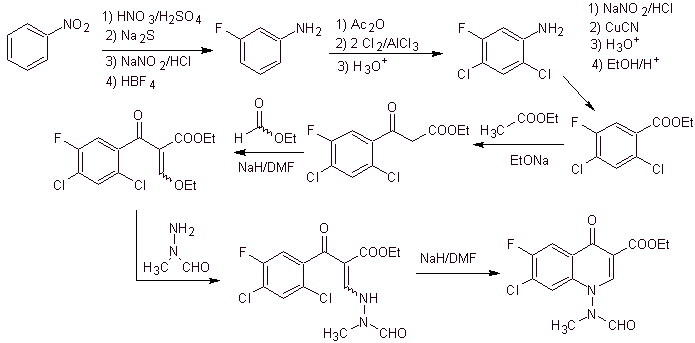
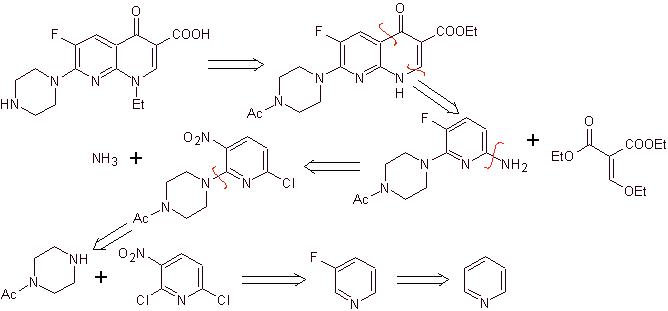
xi) Sintesis dilaporkan oleh Wenthand et al.
Analisis retrosintetik Kuinolon dengan gugus amino tersubstitusi pada posisi 1, seperti amifloksasin, dapat disintesis mengikuti metodologi yang dijelaskan oleh Wentland. Untuk alasan ini, pemutusan diprakarsai oleh tautan N-C. dan kemudian dilanjutkan dengan ikatan NN dan penutupan cincin, berikut reaksi Gould-Jacobs.
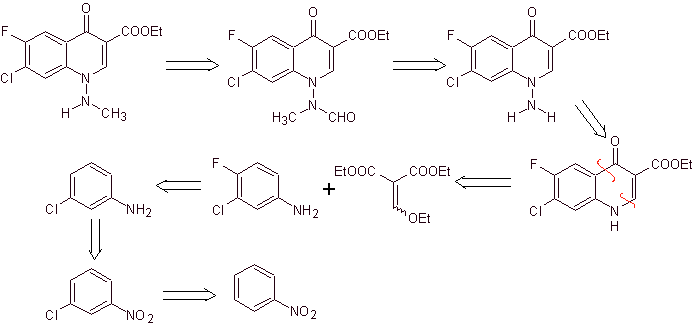
sintesis . Dalam hal ini, gugus amino kuinolon direaksikan dengan reagen yang mentransfer gugus amino lain, yang kemudian diubah menjadi turunan formamida untuk kemudian mengubahnya menjadi senyawa 1-(N-metil)-7-kloro - 6-fluoro-1,4-dihydro-4-oxo-quinoline-3-asam karboksilat.