Síntese de Antibióticos Fluoroquinolonas
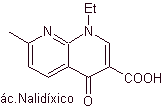
As quinolonas pertencem a um grupo de agentes antibacterianos sintéticos. O agente mais antigo desta família, o ácido nalidíxico, utilizado no início da década de 1960, possui um bom espectro contra enterobactérias (espectro antibacteriano limitado), mas sua farmacocinética não é muito favorável para uso clínico de rotina devido à sua baixa biodisponibilidade. -vida.
Por esta razão, foi necessário sintetizar novos antibacterianos desta família para melhorar o espectro de atividade, o perfil farmacocinético, reduzir os efeitos adversos e o aparecimento de resistência bacteriana. Esse novo grupo são as chamadas fluoroquinolonas, geradas na década de 80.
|
Muitos pesquisadores concordam que a reação de Gould-Jacobs , é a principal base para a síntese das primeiras quinolonas para uso farmacológico, ocorrida na década de 1960, essa reação apresenta a seguinte sequência:
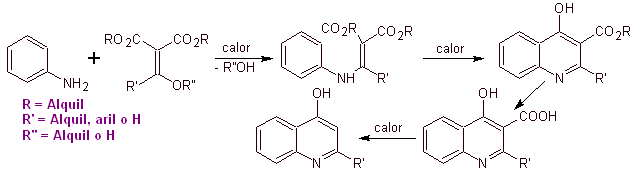
Nos anos seguintes, o flúor na posição 6 e vários grupos de heterociclos na posição 7 foram introduzidos no anel básico das benzoquinolonas, dando origem às fluoroquinolonas com maior espectro antibacteriano.
Partes importantes das metodologias usadas nestas sínteses foram compiladas por Leyva S e Leyva E em um trabalho muito bom de uma perspectiva bioquímica.
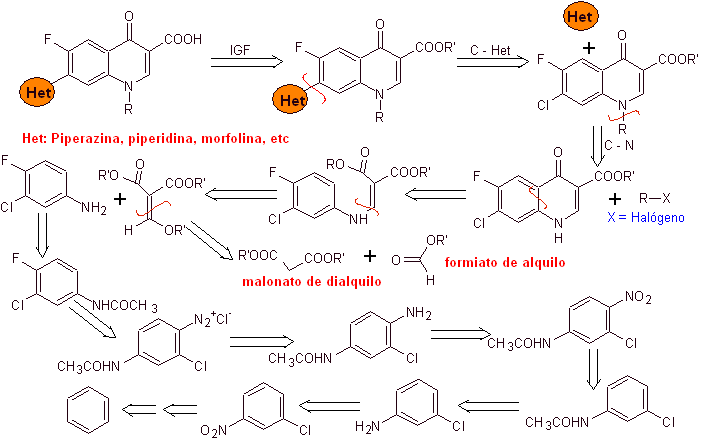
O método de desconexão aplicado ao relato das sínteses em estudo e as reações das primeiras etapas das sínteses são de inteira responsabilidade do autor desta monografia. .
i) Síntese relatada por Koga H. et al.
Análise retrossintética:
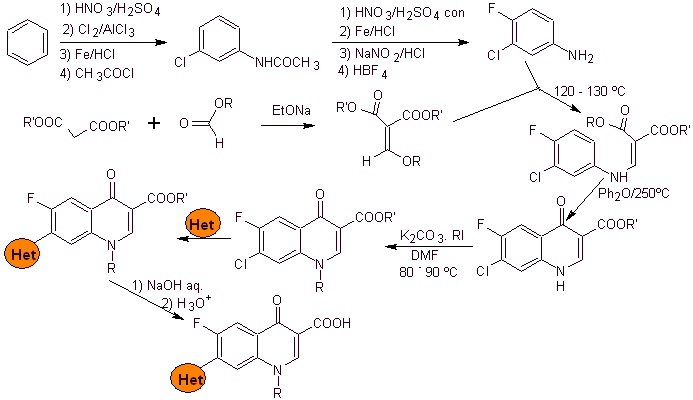
Síntese: Parte do benzeno para formar 3-cloro-4-fluoroanilina, que reage com dietil EMME para produzir o acrilato correspondente, que ao aquecer forma um composto cíclico. Este composto por sua vez é reagido com um agente alquilante e posteriormente é introduzido o composto heterocíclico nitrogenado, para finalmente hidrolisar e obter a molécula alvo.
Análise retrossintética:
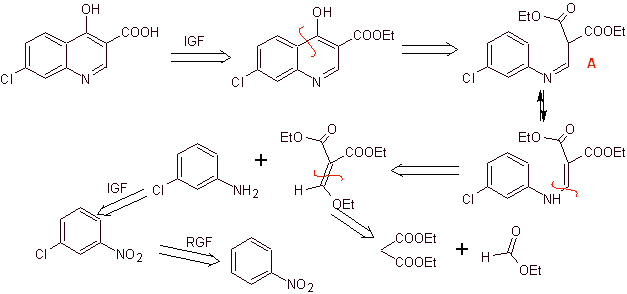
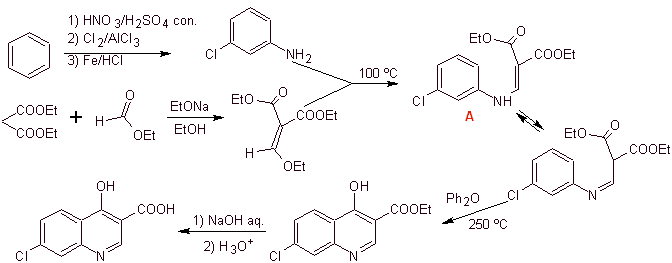
Síntese: A partir do benzeno, para formar 3-cloroanilina com dietil etoximetilenomalonato (EMMET) formado a partir da condensação de etil formato e dietil malonato em meio básico, para produzir o composto A, que é posteriormente aquecido na presença de um éter difenílico para gerar o composto cíclico da quinolina, que é facilmente hidrolisado no ácido correspondente.
iii) Síntese relatada por Grohe e Zeiler
Análise retrossintética: A ligação CN começa a se desconectar e a amina continua se desconectando, para chegar ao composto 1,3-diCO, que poderia ser desconectado como tal, mas a reação proposta por seus autores é respeitada e o malonato de dietila é gerado como intermediário, bem como o derivado multihalogenado de cloreto de benzoíla.
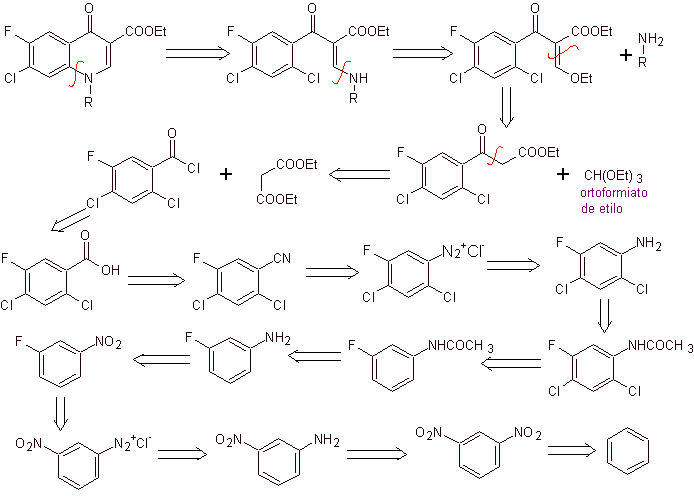
Síntese. A partir do benzeno , pode-se obter acetato de etil benzoíla substituído por flúor e cloro nas posições correspondentes. Este composto é reagido com ortoformato de trietila para produzir o correspondente etoxialceno, onde é possível substituir o grupo etoxi por um grupo amino para produzir a respectiva amina, que é ciclizada com uma base forte para a fluoroquinolona. como pode ser visto flúor, cloro ou nitro participam como possíveis grupos de saída na reação de ciclização. Este método tem sido muito versátil e tem sido usado na síntese de N-aril e N-alquil fluoroquinolonas.
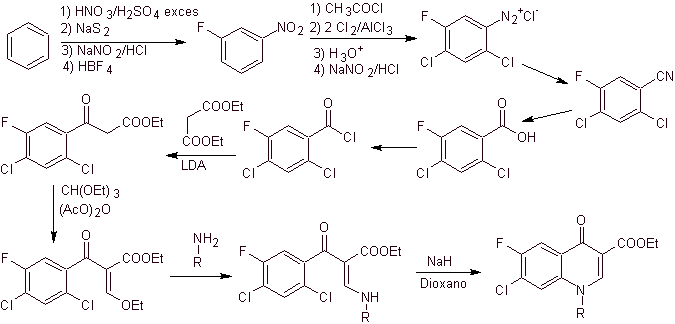
iv) Resumo relatado por Grohe e Heitzer
Análise retrossintética .
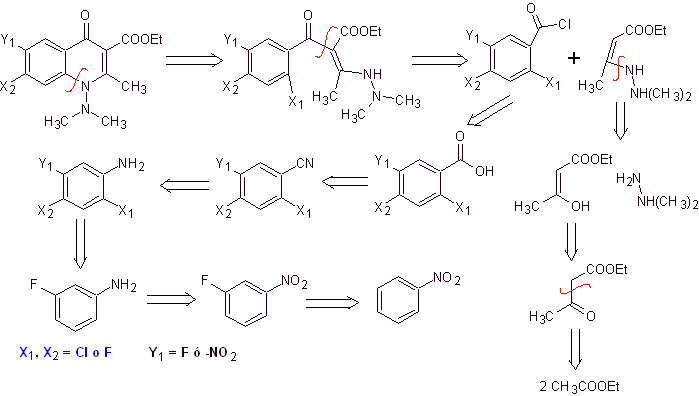
Síntese. Uma rota de síntese convergente é proposta. Uma delas parte da condensação de Claisen de dois moles de acetato de etila, para produzir o acetoacetato de etila, que se combina com o derivado metilado da hidrazina, formando a diamina viníloga, que será utilizada na reação com o derivado do cloreto de benzoíla, formado a partir do nitrobenzeno devido à ação catalítica de uma amina terciária.
O composto formado é ciclizado pela catálise de DBU (1,8-Diazabicil[5.4.0]undec-7-en), para produzir uma fluoroquinolona.
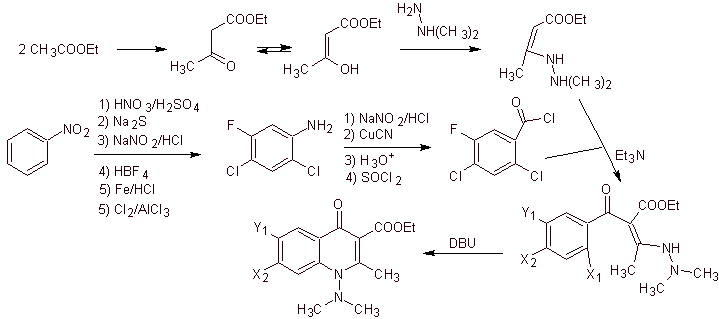
v) Síntese relatada por Torii et al.
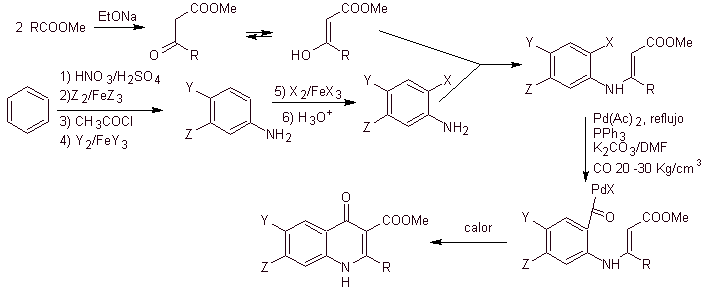
Análise retrossintética. Torii e seus colaboradores em 1990 relataram a síntese de quinolonas fluoradas por meio de um processo de ciclização carbonilativa, catalisada por Pd. Este método é muito adequado para a síntese de fluoroquinolonas, substituídas na posição 2 (R = –Me, -CH 2 COOMe, –COOMe). Uma análise retrossintética desse método começa desconectando a ligação acil e propondo um organocádmio como uma molécula precursora ou equivalente sintético. O restante das desconexões leva à anilina multissubstituída. com halogênios, como segue:
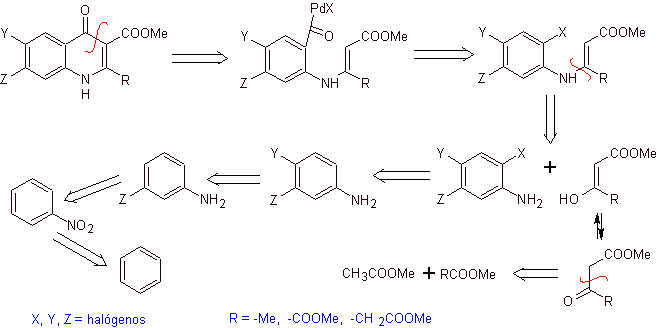
Síntese. O projeto de síntese pode ser esboçado novamente através de uma rota convergente. A primeira rota refere-se à formação do acetoacetato de etila e a segunda, partindo do benzeno para anilina multihalogenada, que irá ciclizar sob condições de carbonização catalítica na presença de paládio. Um aquecimento final do sistema permite a ciclização e a formação da fluoroquinolona.
vi) Síntese relatada por Miyamoto et al.
Análise retrossintética:
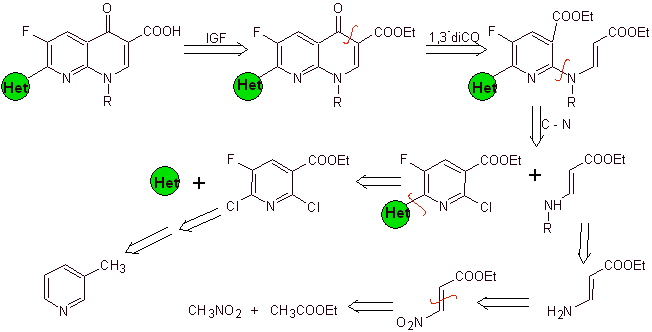
Síntese. Uma vez que os halogênios nas posições 2 e 6 da piridina são altamente reativos, é possível preparar quinolonas pelo procedimento mostrado por Miyamoto et al, no qual o éster de 2,6-dicloropiridina é reagido com uma amina cíclica para dar uma intermediário que é feito reagir com a vinilamina, para então ciclizar em meio básico. Hidrolisado o éster é formado
a fluoroquinolona.
Em qualquer caso, a formação do éster halogenado nas posições 2, 6 com cloro e F em 5. É a parte crítica desta síntese. O éster de piridina multihalogenado pode ser preparado a partir da 3-metilpiridina (beta-picolina), que é obtida a partir da destilação do alcatrão de hulha.
vii) Síntese relatada por Hayakawa
Análise retrossintética: Compostos como flumequina e ofloxacina possuem uma estrutura tricíclica. Sua síntese é realizada segundo Hayakawa et al., a partir de uma estrutura que já contém o anel heterocíclico nitrogenado.
Consequentemente, inicia-se a desconexão pela ligação CO, decorrente da acilação do anel benzênico, e continua a desconexão CN, que deixa uma estrutura bicíclica e EMME (dietil etoximetileno malonato) como equivalentes sintéticos. A continuidade da desconexão depende da natureza de X (-CH 3 , O, S). no caso de ser O ou S, o desligamento pode ser simultâneo conforme indicado. As seguintes operações são IGFs que permitem vislumbrar o benzeno como material de partida.
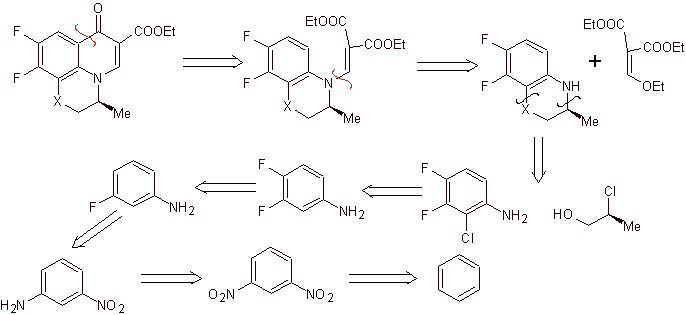
Síntese. As reações de Sandmeyer podem ser adequadamente combinadas para introduzir F e criar condições estruturais para introduzir cloro. A formação do heterociclo pode ser realizada com 2-cloropropanol, formado a partir da abertura de um epóxido adequado. O restante das reações que incluem o uso de EMME já são conhecidas pelos métodos vistos anteriormente para a síntese de fluoroquinolonas.
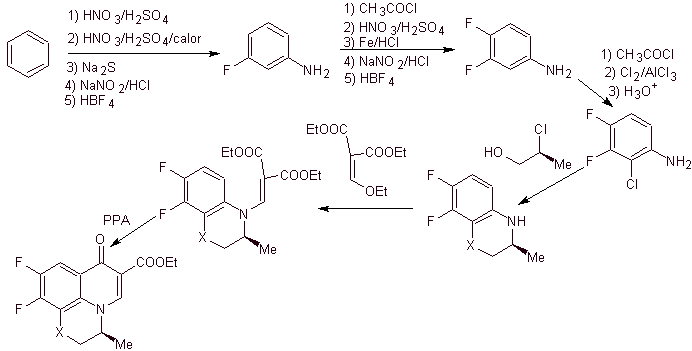
viii) Síntese relatada por Egawa et al.
Análise retrossintética . O composto tricíclico começa a ser desconectado pela ligação C-O, aspecto que permite ver que essa ligação foi resultado de uma ciclização intramolecular de um composto –OH com o F do benzeno. Uma segunda desconexão CN gera uma molécula precursora de amino EMME. As seguintes desconexões são bem conhecidas.
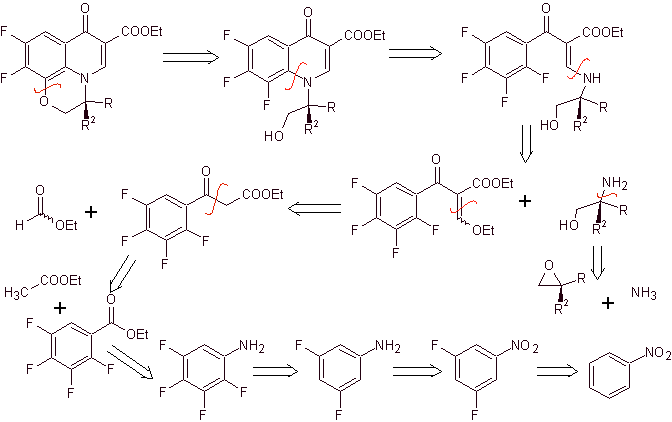
Síntese. A fluoretação exaustiva, por métodos indiretos do benzeno, é realizada primeiro usando o nitrobenzeno como matéria-prima, transformando-o em amina ou amida, para ocupar as demais posições.
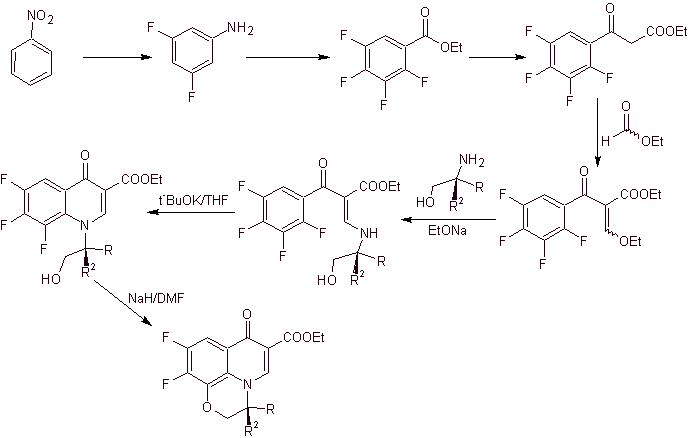
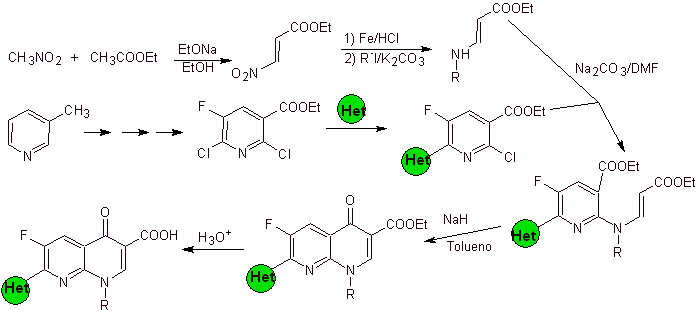
ix) Síntese relatada por Matsumoto et al.
Análise retrossintética.
Síntese: No procedimento relatado por Matsumoto et al. a reação de Gould-Jacobs foi novamente utilizada; partindo de uma nitropiridina diclorada, os intermediários foram sintetizados, primeiro com
O terceiro ciclo é realizado usando EMME e alquilando a amina com iodeto de etila, hidrolisando finalmente os grupos amida e éster.
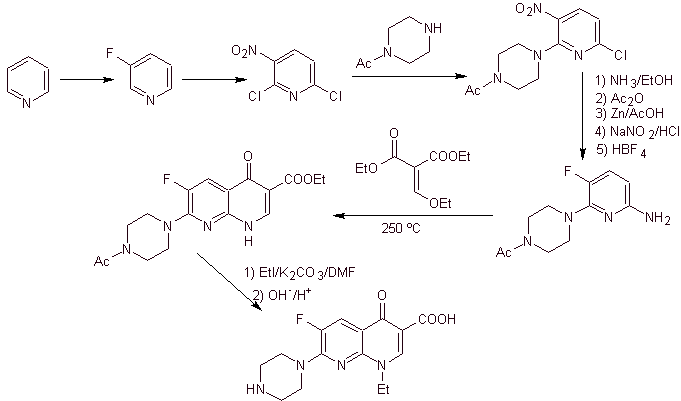
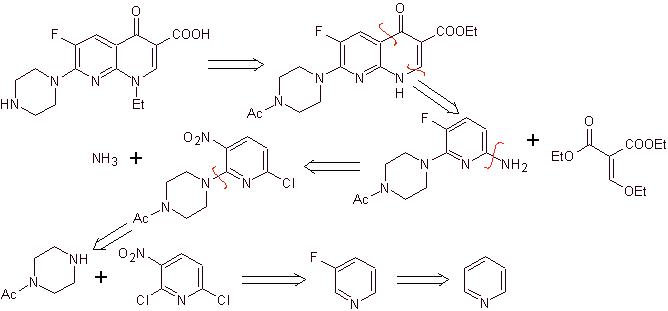
X) Síntese relatada por Chu et al.
Análise retrossintética: Começa desconectando a ligação CN do heterociclo e continua com a CN da amina viníloga. Em EMME, é desconectado pela ligação dupla, para produzir formato de etila como molécula precursora, a próxima desconexão é do tipo 1,3-diCO, que nos ligará à condensação de Claisen. Em seguida, o éster aromático resultante é submetido a vários IGFs, até chegar ao nitrobenzeno como matéria-prima
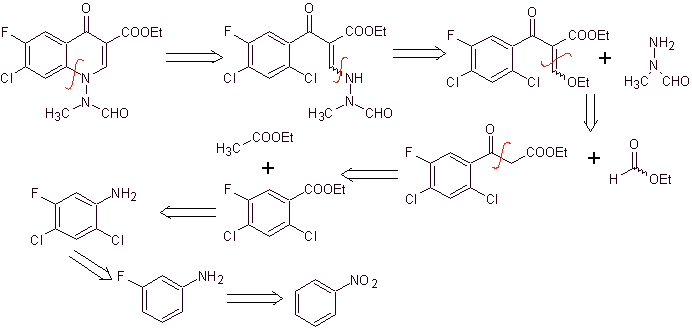
Síntese. Pode-se partir do nitrobenzeno, e com as reações necessárias, chegar aos benzoatos de etila convenientemente substituídos por F e Cl, a partir dos quais se utiliza a condensação de Claisen seguida de outra condensação de Knoevenagel com formato de etila. Este intermediário é então reagido com N-formil-N-metil-hidrazina e com a adição de NaH, a ciclização é alcançada para se chegar ao composto final.
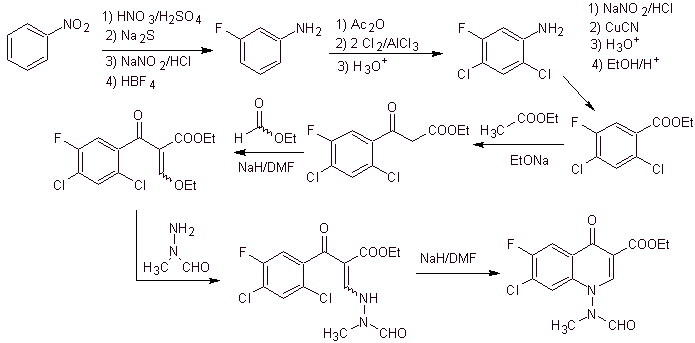
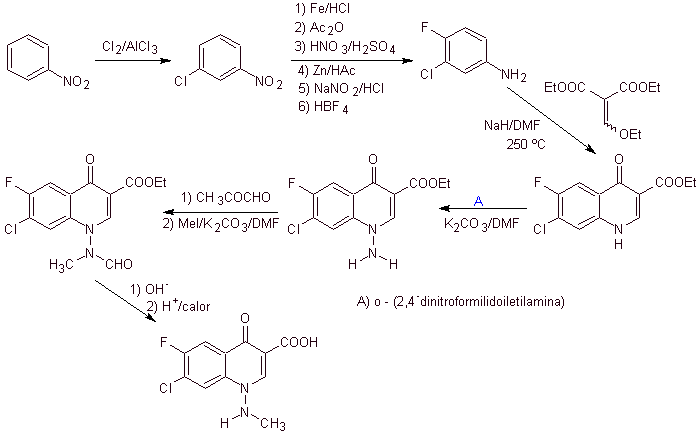
xi) Síntese relatada por Wenthand et al.
Análise retrossintética As quinolonas com um grupo amino substituído na posição 1, como a amifloxacina, podem ser sintetizadas seguindo a metodologia descrita por Wentland. Por esta razão, as desconexões são iniciadas pelo link N-C. e então continua com a ligação NN e o fechamento do anel, segue-se a reação de Gould-Jacobs.
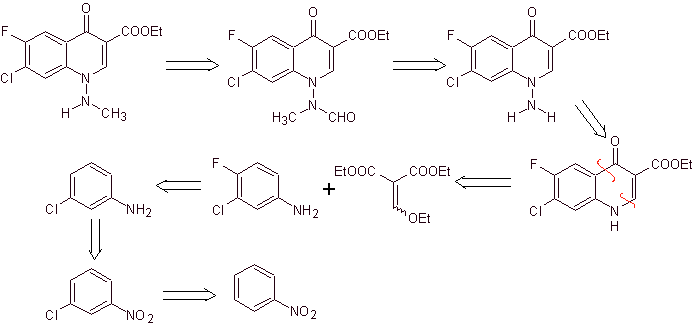
síntese . Neste caso, o grupo amino da quinolona é reagido com um reagente que transfere outro grupo amino, que é posteriormente convertido em um derivado formamida para posteriormente transformá-lo no composto 1-(N-metil)-7-cloro - Ácido 6-fluoro-1,4-di-hidro-4-oxo-quinolina-3-carboxílico.