-
Dettagli
-
Germán Fernández
-
Formule molecolari
-
Visite: 87138
Attualmente sono noti più di 30 milioni di composti chimici, di cui 1 milione sono inorganici e il resto sono organici. I chimici determinano le proprietà fisiche e chimiche di queste sostanze (punti di fusione e di ebollizione, solubilità, densità...). Tuttavia, l'informazione più ambita dal chimico è la determinazione della struttura del composto, che tipo di atomi lo compongono e come questi atomi sono legati.
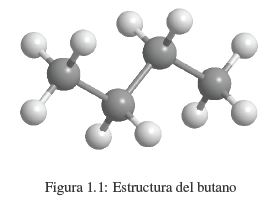
Sappiamo che una sostanza come il butano è composta da carbonio e idrogeno. Ogni molecola contiene 4 atomi di carbonio e 10 atomi di idrogeno, che è rappresentato dalla formula C 4 H 10 , chiamata formula molecolare. Sappiamo anche che gli atomi di carbonio sono legati a formare una catena lineare. 3 idrogeni sono attaccati al primo carbonio, 2 idrogeni al secondo carbonio, 2 idrogeni al terzo carbonio e gli ultimi 3 idrogeni al quarto carbonio.
Leggi tutto: Formule molecolari
-
Dettagli
-
Germán Fernández
-
Formule molecolari
-
Visite: 96377
Consiste nel determinare sperimentalmente la composizione percentuale (in massa) di una sostanza. Quindi, per un composto di formula molecolare C 4 H 10 la composizione percentuale è: 82,66% C e 17,34% H.
L'analisi elementare di un composto viene effettuata in un apparecchio, chiamato analizzatore, dove un campione pesato viene bruciato con grande precisione (circa 5 mg). Il carbonio viene trasformato in CO 2 , l'idrogeno in H 2 O e l'azoto in N 2 , determinato mediante gascromatografia. L'ossigeno non viene solitamente analizzato ed è determinato per differenza.
Leggi tutto: Analisi elementare
-
Dettagli
-
Germán Fernández
-
Formule molecolari
-
Visite: 89759
Dalla composizione centesimale di un composto chimico possiamo determinare la sua formula empirica. La formula molecolare è ottenuta da quella empirica utilizzando la massa molecolare del composto, che può essere determinata mediante spettrometria di massa.
Determinazione della formula empirica e molecolare del cortisone
La composizione percentuale del cortisone è: 69,96% di C; 7,83% H e 22,21% O. Determinare la formula empirica. Sapendo che la massa molecolare è 360,43, ottieni la formula molecolare.
Leggi tutto: Calcolo di formule empiriche e molecolari
-
Dettagli
-
Germán Fernández
-
Formule molecolari
-
Visite: 82008
L'indice di insaturazione di una molecola è definito come la somma del numero di legami \(\pi\) e il numero di cicli presenti. Gli alcani sono idrocarburi saturi in quanto non contengono legami \(\pi\) o cicli e hanno la formula molecolare \(C_nH_{2n+2}\). Per calcolare l'indice di insaturazione di un composto basta confrontare il numero di idrogeni che possiede con quelli che avrebbe se fosse un alcano con lo stesso numero di atomi di carbonio. Questa differenza di idrogeno divisa per 2 ci dà l'indice di insaturazione.
Gli alcheni sono composti che contengono doppi legami carbonio-carbonio. Gli alcheni rispondono alla formula molecolare \(C_nH_{2n}\). A parità di atomi di carbonio hanno due idrogeni in meno di un alcano, sono detti composti insaturi (hanno insaturazione).
Leggi tutto: indice di insaturazione