Le molecole organiche distribuiscono i loro elettroni in diversi livelli elettronici chiamati orbitali molecolari. Gli orbitali molecolari a più bassa energia sono $\sigma$, seguiti dagli orbitali $\pi$. Quando nella molecola sono presenti atomi con coppie elettroniche libere (ossigeno, zolfo, azoto, alogeni) avremo livelli di non legame n. Questi livelli elettronici sono disposti nella regione di legame del diagramma. Nella regione di antilegame troviamo gli orbitali molecolari $\pi^{\ast}$ e $\sigma^{\ast}$. Una molecola nel suo stato fondamentale ha orbitali di legame e non di legame occupati e orbitali di antilegame non occupati.
Da quanto discusso sopra, si può dedurre che le transizioni elettroniche devono iniziare dagli orbitali di legame e di non legame e terminare in quelli di antilegame. Così possiamo avere i 5 tipi di transizioni elettroniche mostrate nel diagramma seguente.
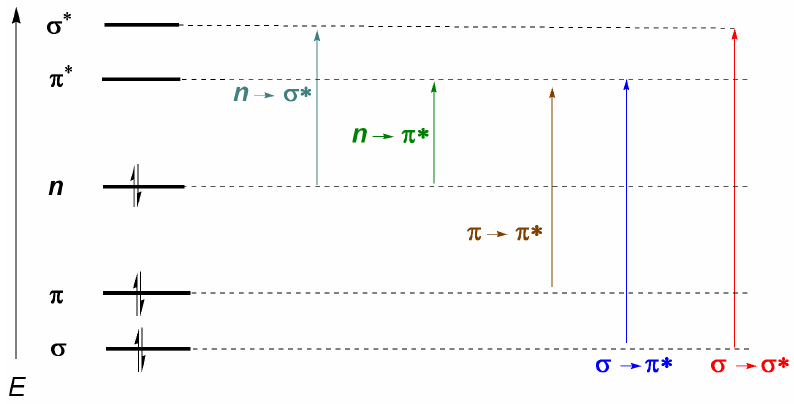
La transizione elettronica più importante è solitamente dall'HOMO (ultimo orbitale occupato) al LUMO (primo orbitale vuoto) che corrisponde al più piccolo salto energetico e corrisponde a una lunghezza d'onda lunga.
Negli alcani sono possibili solo $\sigma \rightarrow \sigma^{\ast}$ transizioni (etano: $\lambda =135\;nm$). Queste bande non possono essere osservate con spettrofotometri commerciali, poiché scansionano da 200 nm. Tuttavia, le molecole che presentano doppi legami coniugati presentano transizioni $\pi \rightarrow \pi^{\ast}$ che possono essere osservate (butadiene: $\lambda =217\;nm$).
Quando ci sono atomi con coppie solitarie nella molecola, la transizione con l'energia più bassa (lunghezza d'onda maggiore) è $n\rightarrow \pi$. Tuttavia, è una transizione improbabile, poiché non c'è sovrapposizione tra i due orbitali, causando bande molto deboli. Da quest'ultimo commento segue la regola di selezione per la spettroscopia UV-visibile: $n\rightarrow \pi^{\ast}$ le transizioni sono "proibite". Una transizione a bassa probabilità si intende vietata.