Gli zuccheri in soluzione si trovano principalmente in una forma ciclica, chiamata emiacetale. L'emiacetale si ottiene attaccando uno dei gruppi idrossilici della catena sul carbonile. I cicli formati sono di cinque o sei membri.
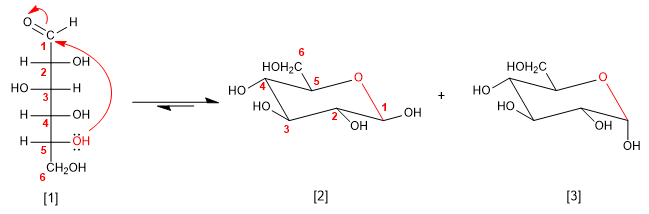
[1] D-Glucosio
[2] b -D-glucopiranosio
[3] a -D-glucopiranosio
Per disegnare l'emiacetale posizioniamo gli -OH che sono a destra nella proiezione di Fischer verso il basso nella sedia, mentre quelli a sinistra sono orientati verso l'alto.
L'-OH in posizione 1 (-OH attaccato al carbonio anomerico) può assumere due orientamenti che danno origine ad anomeri alfa (-OH down) e beta (-OH up). Invece il -CH 2 OH che parte dal carbonio 5 sarà orientato verso l'alto negli zuccheri della serie D, mentre sarà orientato verso il basso in quelli L.
Il glucosio può anche ciclizzare come un 5-anello (furanosio), per attacco dell'ossidrile in posizione 4 sul carbonile.
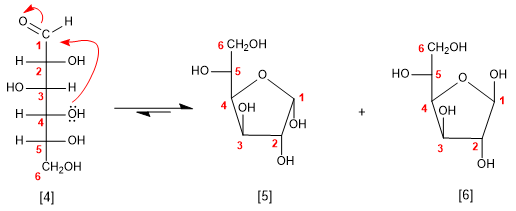
[4] D-Glucosio
[5] a-D-glucofuranosio
[6] b -D-glucofuranosio
Sebbene la forma emiacetale sia predominante nel mezzo acquoso, esiste in equilibrio con una piccola frazione di molecole aperte. Pertanto, le reazioni che agiscono sul gruppo carbonilico (ossidazioni o riduzioni) eliminano la forma aperta dal mezzo, provocando uno spostamento verso sinistra dell'equilibrio, producendo l'apertura degli emiacetali.
La forma piranosica è più stabile del furanosio nel caso del glucosio
Seguendo le regole sopra indicate, ciclicheremo la molecola di arabinosio. L'attacco dell'ossidrile a 4 posizioni genera un emiacetale a 5 membri (furanosio).
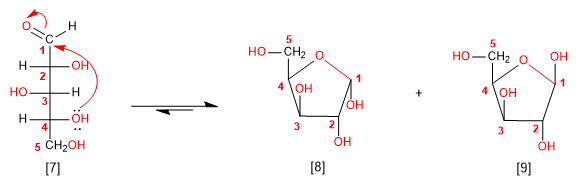
[7] D-Arabinosio
[8] a -D-Arabinofuranosio
[9] b -D-Arabinofuranosio
Possiamo anche ciclizzare l'arabinosio dall'idrossile in posizione 5, generando cicli a 6 membri (piranosio)
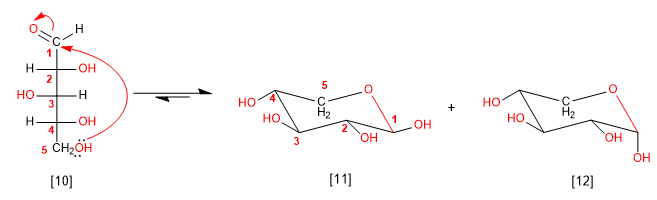
[10] D-Arabinosio
[11] b-D-Arabinopiranosio
[12] a-D-arabinopiranosio