Os açúcares em solução são encontrados principalmente na forma cíclica, chamada de hemiacetal. O hemiacetal é obtido atacando um dos grupos hidroxila da cadeia na carbonila. Os ciclos formados são de cinco ou seis integrantes.
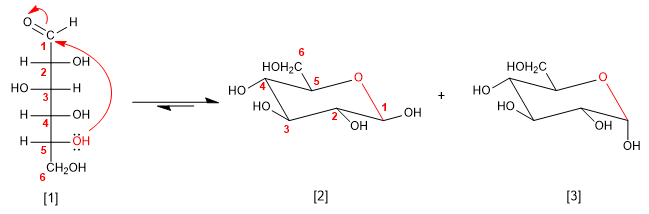
[1] D-Glicose
[2] b -D-Glucopiranose
[3] a -D-Glupiranose
Para desenhar o hemiacetal colocamos os -OHs que estão à direita na projeção de Fischer para baixo na cadeira, enquanto os que estão à esquerda estão orientados para cima.
O -OH na posição 1 (-OH ligado ao carbono anomérico) pode assumir duas orientações que dão origem aos anômeros alfa (-OH para baixo) e beta (-OH para cima). Por outro lado, o -CH 2 OH que parte do carbono 5 será orientado para cima nos açúcares da série D, enquanto será orientado para baixo nos açúcares da série L.
A glicose também pode ciclizar como um anel 5 (furanose), por ataque da hidroxila da posição 4 na carbonila.
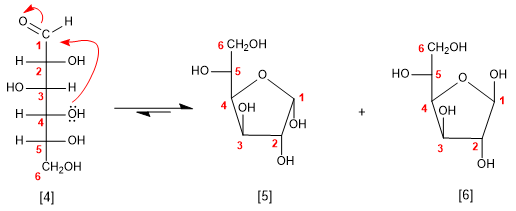
[4] D-Glicose
[5] a -D-Glucofuranose
[6] b -D-Glucofuranose
Embora a forma hemiacetal seja predominante no meio aquoso, ela existe em equilíbrio com uma pequena fração de moléculas abertas. Assim, as reações que atuam sobre o grupo carbonila (oxidações ou reduções) eliminam a forma aberta do meio, fazendo com que o equilíbrio se desloque para a esquerda, produzindo a abertura dos hemiacetais.
A forma da piranose é mais estável que a furanose no caso da glicose
Seguindo as regras indicadas acima, vamos fazer o ciclo da molécula de arabinose. O ataque da hidroxila na posição 4 gera um hemiacetal de 5 membros (furanose).
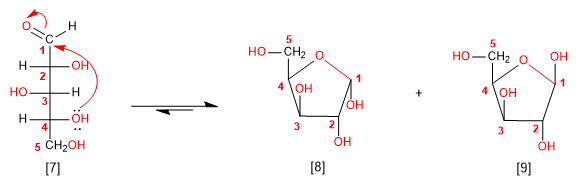
[7] D-Arabinose
[8] a -D-Arabinofuranose
[9] b -D-Arabinofuranose
Podemos também ciclizar a arabinose a partir da hidroxila na posição 5, gerando ciclos de 6 membros (piranose)
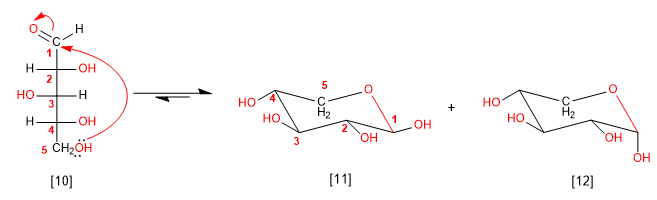
[10] D-Arabinose
[11] b -D-Arabinopiranose
[12] a -D-Arabinopiranose