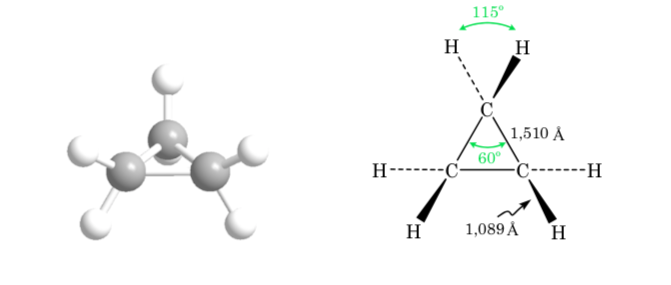
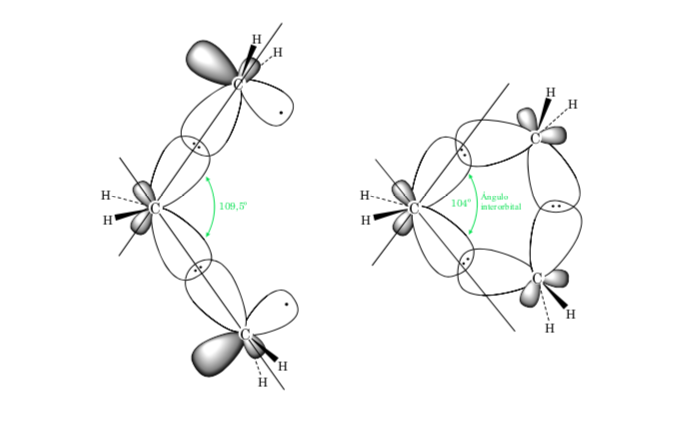
Stereochimica e analisi conformazionale
La stereochimica è la branca della chimica che si occupa degli aspetti tridimensionali delle molecole e della loro reattività. La chimica organica non può essere compresa senza considerare la stereochimica. I sistemi biologici sono altamente selettivi e spesso discriminano molecole con differenze stereochimiche molto piccole.
L'analisi conformazionale fa parte dello studio spaziale delle molecole, cioè della stereochimica.
COSTITUZIONE, CONFIGURAZIONE E CONFORMAZIONE
I composti con la stessa formula si chiamano isomeri.
struttura empirica ma diversa.
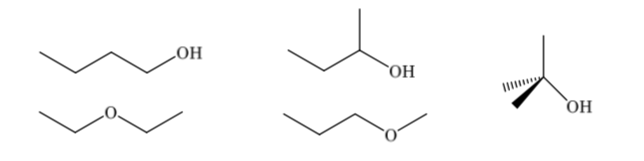
Gli isomeri costituzionali differiscono nella loro sequenza di legame, presentano connettività diversa. Un composto con formula molecolare C4H10O può avere diverse costituzioni:
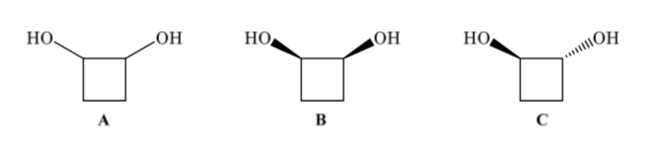
Gli isomeri configurazionali hanno la stessa connettività ma differiscono nella disposizione spaziale degli atomi. L'1,2-ciclobutandiolo (A) può avere due isomeri configurazionali a seconda che i due gruppi OH siano sullo stesso lato (B) o su lati opposti (C)
Gli isomeri conformazionali hanno la stessa costituzione, la stessa configurazione, ma differiscono spazialmente in quanto passano da un isomero all'altro per semplice rotazione di un legame. Le varie forme che le molecole acquisiscono come risultato della rotazione attorno a un singolo legame sono chiamate conformazioni, ciascuna delle quali è un conformero.
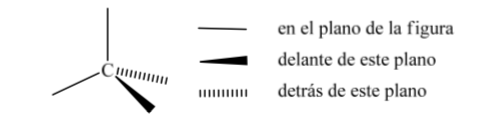
Una delle rappresentazioni più utilizzate del tetraedro di carbonio è la cosiddetta rappresentazione prospettica.
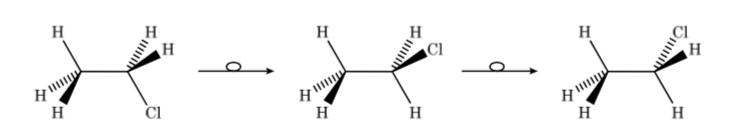
Pertanto, nel caso del cloroetano possiamo rappresentare i diversi conformeri in prospettiva come segue:
Gli isomeri configurazionali e conformazionali sono stereoisomeri. Gli stereoisomeri hanno la stessa connettività ma differiscono nell'orientamento di alcuni dei loro atomi nello spazio. Spesso presentano notevoli differenze nelle loro proprietà fisiche, chimiche e biologiche.
CONFORMAZIONE IN MOLECOLE ORGANICHE ACICLCHE
Rappresentazione di molecole organiche
Esistono diversi modi per rappresentare le molecole nel piano.
Rappresentazione in prospettiva o cavalletto
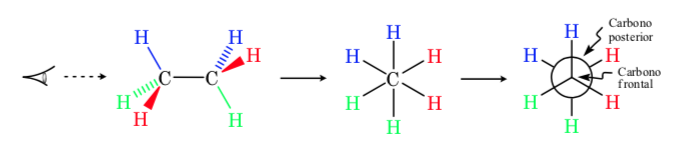
Proiezione di Newman
In una proiezione di Newman, due atomi di carbonio adiacenti in una molecola sono raffigurati all'interno di un cerchio. Nella parte anteriore è l'atomo di carbonio visto dalla parte anteriore e dietro il cerchio è l'atomo di carbonio sovrapposto. I tre sostituenti di ciascun carbonio escono dal centro del cerchio davanti e dietro.
Rappresentazione del pescatore
Nella rappresentazione di Fischer, un atomo di carbonio tetraedrico è rappresentato dal centro di una croce e i sostituenti sono posti alle estremità in modo tale che le linee verticali indichino che i legami sono diretti verso il dorso del piano della carta e il quelli orizzontali verso la parte anteriore. . La catena principale è disposta verticalmente.
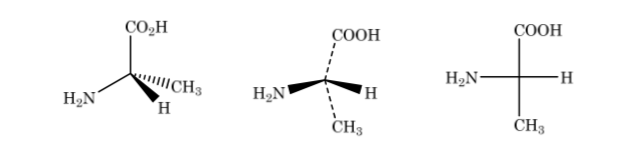
Come mostrato sopra la rappresentazione dell'acido 2-amminopropanoico
Se il composto ha atomi di carbonio diversi, la catena di carbonio viene disegnata verticalmente con i sostituenti di ciascun carbonio orizzontalmente, mantenendo sempre la regola che i legami verticali vanno dietro il piano e quelli orizzontali in avanti.
Conformazioni dell'etano
Il legame σ che unisce gli atomi di carbonio nell'etano è cilindricamente simmetrico e consente la libera rotazione attorno ad esso. La rotazione attorno al legame C–C interconverte le diverse conformazioni dell'etano. Lo studio del suo comportamento termodinamico e cinetico si chiama Analisi Conformazionale.
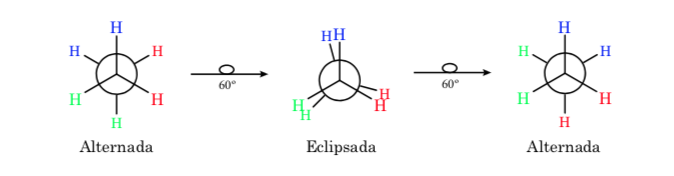
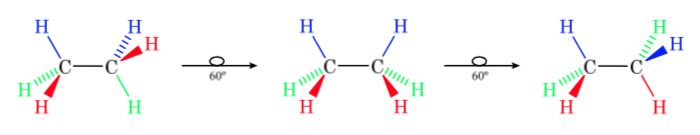
La prima figura rappresenta la molecola di etano in cui gli atomi di idrogeno sono il più distanti possibile con una minima interazione tra di loro. Si chiama conformazione alternativa.
Il secondo deriva dall'aver fatto un giro di 60° al legame C–C e dove gli atomi di idrogeno sono eclissati.
Ancora una volta, una rotazione di 60° del legame C–C porta a una conformazione alternativa.
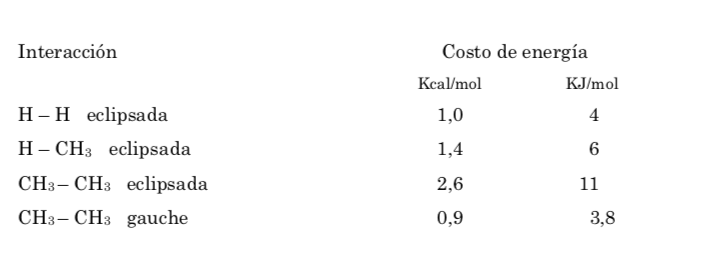
L'energia potenziale della molecola è minima per la conformazione sfalsata, aumenta con la rotazione e raggiunge un massimo per la conformazione eclissata. La differenza energetica o barriera energetica da superare per passare da una conformazione all'altra è dell'ordine di 3 kcal (vedi disegno).
La maggior parte delle molecole di etano esiste naturalmente nella conformazione più stabile. Poiché la barriera energetica non è molto alta a temperatura ambiente, il numero di collisioni con energia sufficiente è abbastanza grande da rendere veloce l'interconversione del conformero. L'energia richiesta per ruotare la molecola attorno al legame C-C è dovuta alla deformazione torsionale.
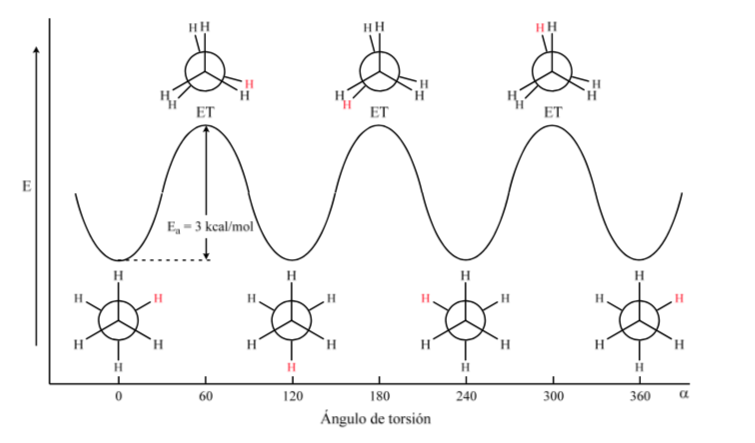
Il diagramma sopra rappresenta i cambiamenti di energia quando si passa da una conformazione all'altra durante la rotazione del legame singolo C-C.
Quando gli idrogeni etanici vengono sostituiti da altri atomi o gruppi, i livelli energetici delle conformazioni cambieranno e il loro studio dovrà essere effettuato caso per caso.
conformazioni del propano
Nel caso della molecola del propano, se rappresentiamo le proiezioni di Newman secondo uno dei legami C – C e ruotiamo il legame, ci troviamo, come nel caso dell'etano, con conformazioni eclissate e alternate.
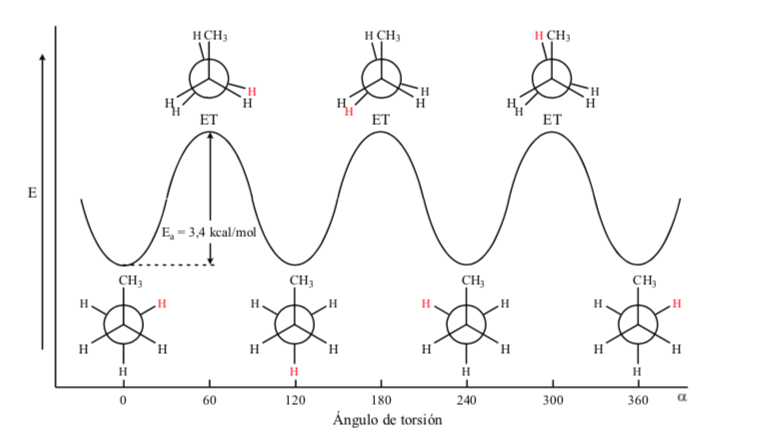
La barriera energetica tra una forma alternativa e una eclissata è maggiore che nel caso dell'etano (3,4 kcal mol-1) poiché il gruppo metilico è più grande dell'idrogeno e le interazioni sono maggiori. Le conformazioni sfalsate sono più stabili delle conformazioni eclissate.
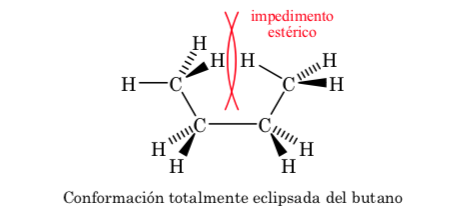
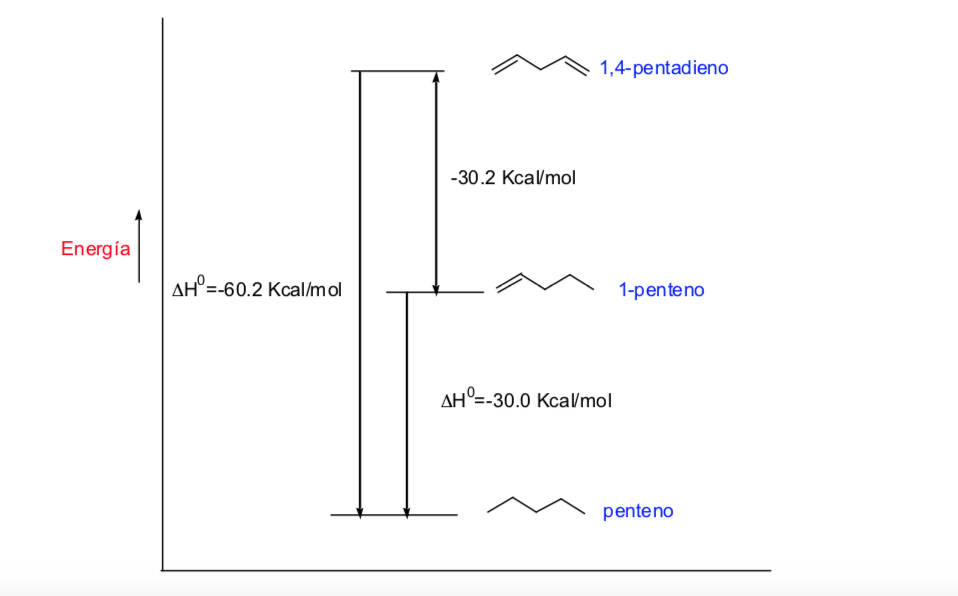
Conformazioni dell'n-Butano
Se guardiamo al legame C–C centrale, possiamo considerare il butano quando lo rappresentiamo in Newman come una molecola simile all'etano in cui due atomi di idrogeno sono stati sostituiti da due gruppi metilici.
Come nell'etano, le conformazioni alternate hanno un'energia inferiore e sono più stabili di quelle eclissate: 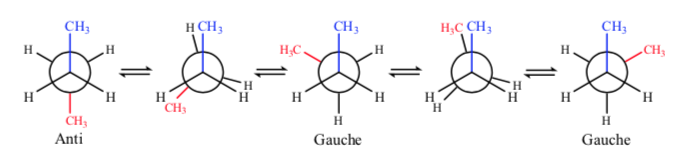
Di tutte le conformazioni alternate, quella con i due gruppi metilici nella posizione più opposta possibile (angolo diedro 180o) è chiamata anticonformazione ed è la più stabile. Le altre due conformazioni alternative sono di energia simile l'una all'altra e sono chiamate conformazioni gauche dove i gruppi metilici si incontrano con un angolo diedro di 60° l'uno rispetto all'altro. Esistono due di queste conformazioni a seconda della rotazione attorno al legame C-C.
Delle tre conformazioni eclissate, evidenziamo per prima quella in cui i due gruppi metilici sono eclissati, che genera maggiore interazione e quindi minore stabilità. Le altre due conformazioni eclissate hanno un contenuto energetico inferiore e sono in qualche modo più stabili. Vedi il diagramma energetico.
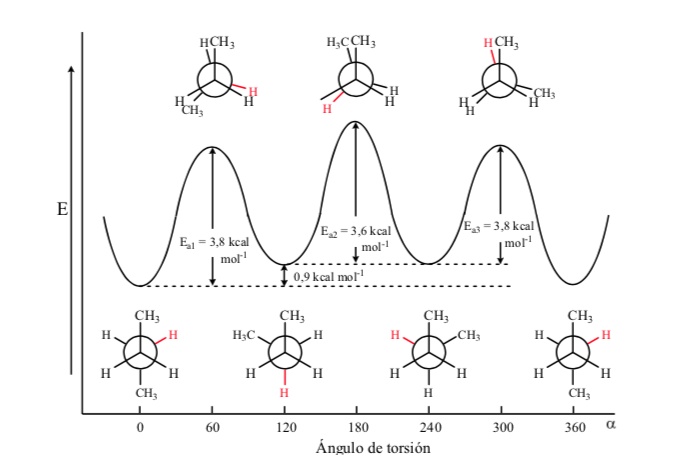
Le collisioni forniscono l'energia necessaria per superare la barriera energetica di attivazione.
CONFORMAZIONE IN MOLECOLE ORGANICHE CICLCHE
I cicloalcani sono soggetti a un ceppo ad anello chiamato ceppo Bayer a causa della loro struttura ciclica. Questa tensione è il risultato di tre fattori:
- Tensione di collegamento
- Eclisse di atomi e legami - Strain sterico
A. La deformazione del legame nei cicloalcani è dovuta alla differenza nella sovrapposizione orbitale rispetto a un alcano aciclico. Più il valore dell'angolo C–C–C è vicino al tetraedro (109,5o), maggiore è la sovrapposizione e minore è la tensione del legame.
L'effetto sterico è dovuto all'interazione degli atomi attraverso lo spazio. Per evitare che l'interazione tra gli atomi sia elevata, la molecola acquisisce una conformazione preferenziale, questa è la più stabile. Per ridurre le sollecitazioni e quindi raggiungere la stabilità, la conformazione preferita sarà quella in cui i gruppi voluminosi sono il più distanti possibile.
CONFORMAZIONE IN CICLI DI TRE, QUATTRO E CINQUE ATOMI DI CARBONIO
ciclopropano
La deviazione dell'angolo di legame dell'anello a tre membri dall'angolo corrispondente all'ibridazione sp3 è grande, quindi il ciclopropano ha una deformazione angolare molto elevata.
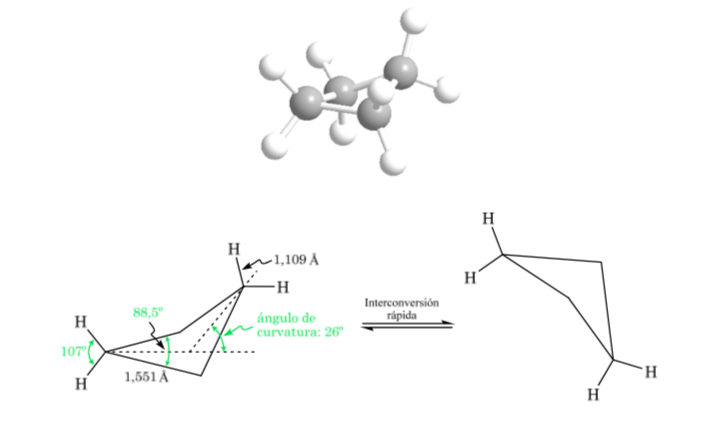
Ciclobutano: conformazione a farfalla
La molecola ha una struttura leggermente deformata. I legami C–C sono meno curvi e la loro reattività è inferiore rispetto al caso del ciclopropano. L'interconversione tra le diverse conformazioni è rapida.
Ciclopentano: Conformazione attiva
Il ciclopentano, se fosse planare, avrebbe un'elevata tensione di eclisse, a causa di dieci interazioni H-H eclissate, con conseguente piegatura nell'anello. La piegatura rilascia lo stress torsionale. Il ciclopentano non mostra la reattività degli anelli a tre e quattro membri.
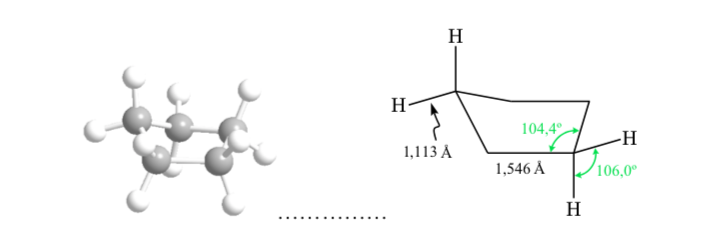
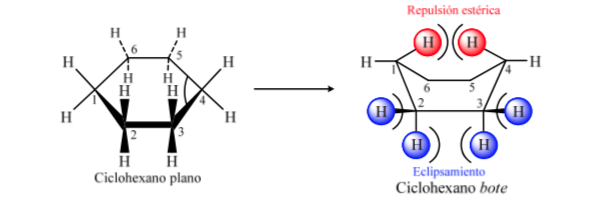
ANALISI CONFORMAZIONALE DEI CICLOESANI: Conformazione a sedia
Se il cicloesano avesse una struttura planare, avrebbe un angolo di legame di 120o. Un carbonio ibridato sp3 privo di tensione ha un angolo tetraedrico di 109,5o, che fa assumere al cicloesano una conformazione non planare e più stabile: conformazione a sedia.
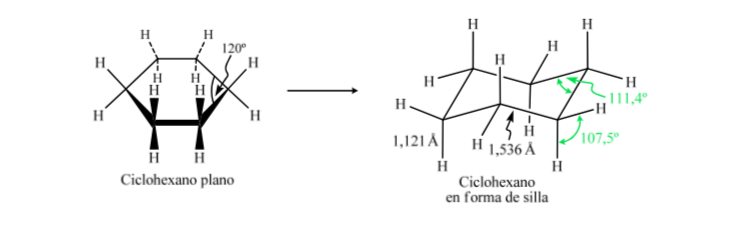
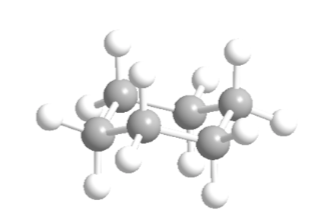
Il cicloesano nella conformazione a sedia ha 6 atomi di idrogeno assiali e 6 idrogeni equatoriali. Gli idrogeni assiali sono diretti su e giù per l'anello, mentre gli idrogeni equatoriali sono diretti fuori dall'anello.
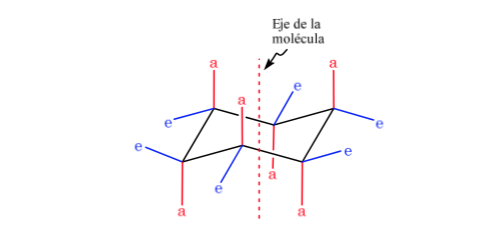
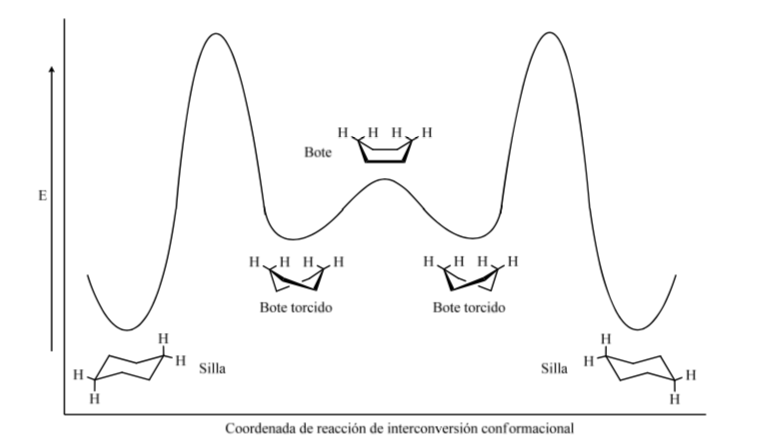
Il cicloesano nella conformazione a sedia è suscettibile di modificare la sua conformazione da parte di un'altra sedia di uguale stabilità. Questo fenomeno è chiamato interconversione di due forme di sedia.
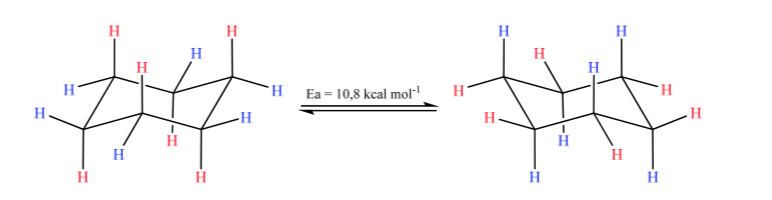
Osservando da vicino l'interconversione, si osserva che il legame C–H assiale diventa equatoriale e viceversa, l'equatoriale diventa assiale.
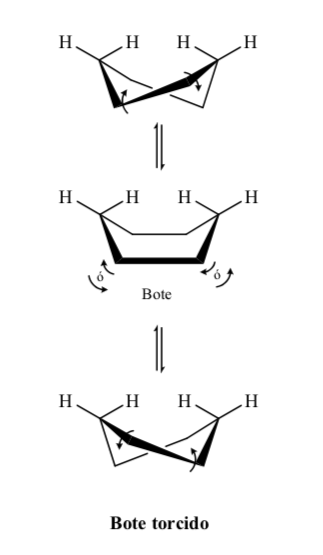
Livelli energetici dei conformeri del cicloesano:
Se osserviamo una conformazione a sedia del cicloesano tale che l'atomo C-2 si sovrappone all'atomo C-3 e l'atomo C-6 si sovrappone al C-5 possiamo disegnare una proiezione di Newman del cicloesano:
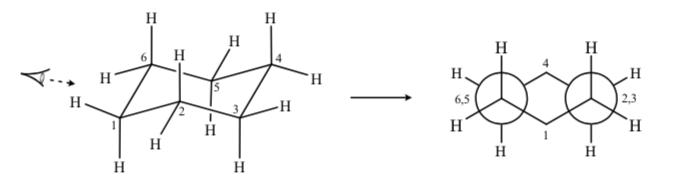
CICLOESANI SOSTITUITI
Se consideriamo il metilcicloesano, possiamo proporre due strutture che lo rappresentano a seconda che il gruppo metile sia in posizione assiale o equatoriale.
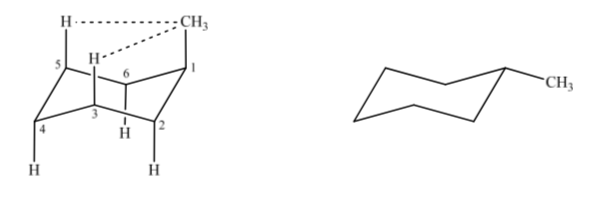
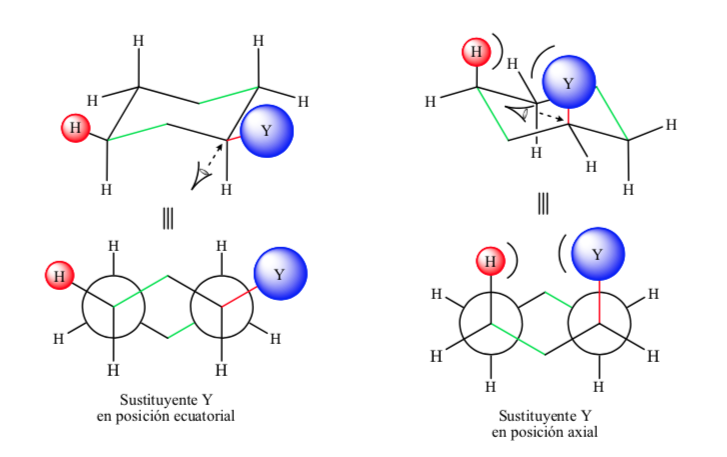
Se il sostituente non idrogeno è in posizione assiale, le interazioni con gli idrogeni in posizione 3 e 5 dell'anello si verificano a causa della vicinanza spaziale. Se è in posizione equatoriale, il sostituente è diretto fuori dall'anello e le interazioni sono minori. Come previsto, la conformazione con il sostituente equatoriale risulta essere circa 1,8 kcal più stabile che se il sostituente è in posizione assiale. Si dice quindi che un sostituente in posizione assiale presenta un'interazione 1,3-diassiale che lo rende meno stabile che in posizione equatoriale.
La figura seguente rappresenta il Newman le due conformazioni di un cicloesano sostituito con entrambi i sostituenti nelle posizioni equatoriale e assiale.
Cicloesani disostituiti
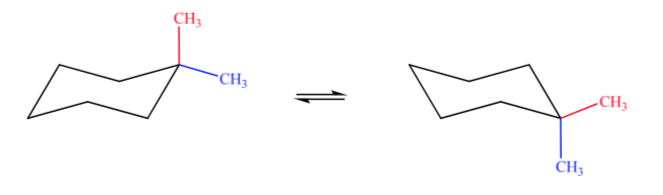
A. 1,1-dimetilcicloesano B. 1,2-dimetilcicloesano C. 1,3-dimetilcicloesano D. 1,4-dimetilcicloesano
Nel caso A, un gruppo metilico sarà in posizione assiale e l'altro in posizione equatoriale, quindi le due possibili conformazioni saranno ugualmente stabili.
In ciascuno dei restanti casi possiamo rappresentare due strutture diverse a seconda che i due metili siano in cis (diretti verso lo stesso lato del piano) o in trans (diretti verso lati opposti).
In B, l'isomero cis deve avere entrambi i metili sullo stesso lato del piano centrale, quindi un metile sarà assiale e l'altro equatoriale.
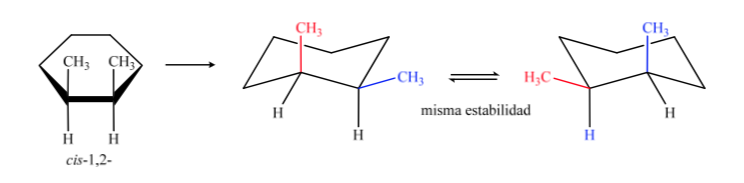
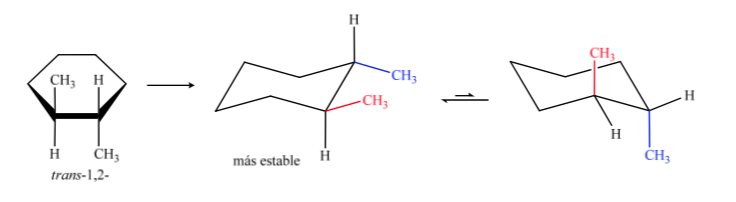
L'isomero trans è quello con i due metili rivolti verso lati opposti, quindi presenterà entrambi i metili in posizione assiale o entrambi in posizione equatoriale. La conformazione che entrambi presentano in equatoriale è più stabile che in assiale, quindi possiamo dire che l'isomero trans-1,2-dimetilcicloesano è più stabile dell'isomero cis-1,2-dimetilcicloesano.
Nel caso dell'1,3-dimetilcicloesano possiamo rappresentare:
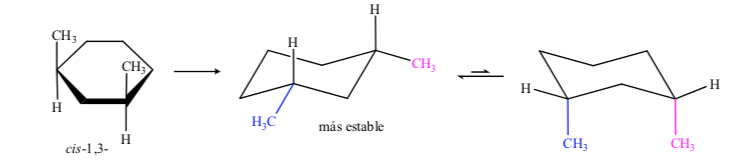
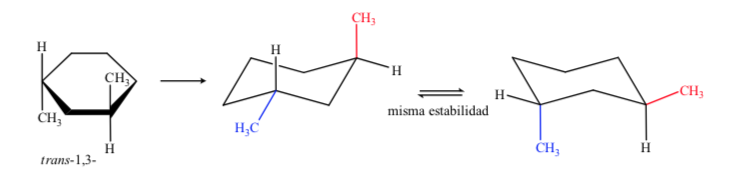
Si conclude che l'isomero cis, che presenta i due sostituenti in equatoriale, è più stabile del trans, che avrà sempre un metile in assiale e un altro in equatoriale.
Nel caso D, 1,4-dimetilcicloesano avremo:
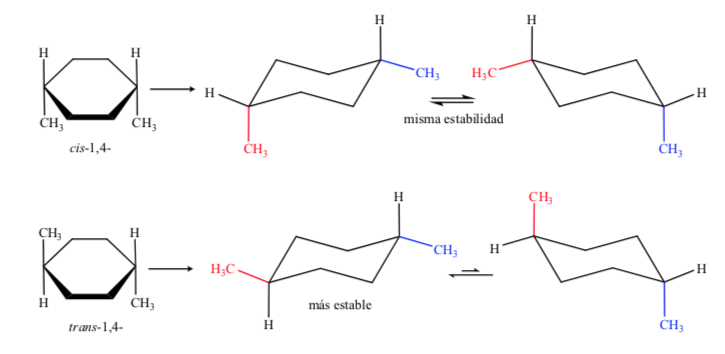
In questo caso, l'isomero trans è più stabile perché i due metili sono disposti in equatoriale.
Quando si ha a che fare con cicloesani disostituiti con gruppi diversi, l'isomero più stabile sarà quello con il gruppo equatoriale più grande.
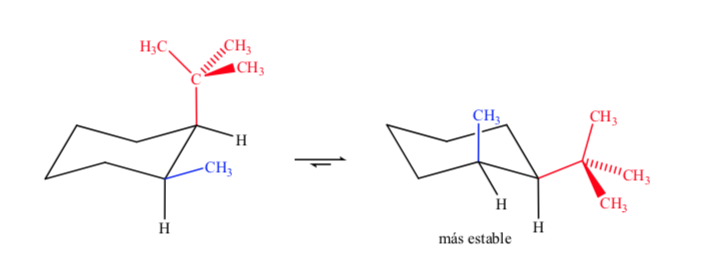
Infine, nel caso di cicloesani polisostituiti con sostituenti diversi, la conformazione preferita sarà quella con il maggior numero di gruppi voluminosi in posizione equatoriale.
CONFORMAZIONE IN ETEROCICLI A SEI MEMBRI:
EFFETTO ANOMERICO
In chimica organica, l'effetto anomerico o effetto Edward-Lemieux è un effetto stereoelettronico che descrive la tendenza dei sostituenti eteroatomici adiacenti a un eteroatomo in un anello cicloesano a preferire l'orientamento assiale piuttosto che l'orientamento equatoriale meno coperto, che ci si aspetterebbe. considerazioni steriche. Questo effetto è stato originariamente osservato negli anelli piranosici da JT Edward nel 1955; a quel tempo, N.-J. Chii e Raymond U. Lemieux iniziarono a studiare l'equilibrio di anomerizzazione di derivati completamente acetilati di alcune aldoesopiranosi. Il termine "effetto anomerico" è stato introdotto nel 1958.
Alcuni degli eterocicli a cinque e sei membri più comuni nei processi biologici sono:
A. Eterocicli ossigenati:
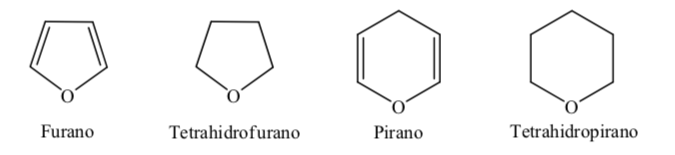
B. Eterocicli azotati:
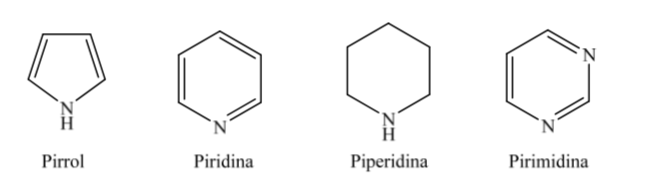
Quando si tratta di eterocicli completamente idrogenati con cinque e sei membri come il tetraidrofurano e il tetraidropirano, la conformazione più stabile che presentano è simile a quella rispettivamente del ciclopentano e del cicloesano, cioè conformazione su sedia o conformazione.
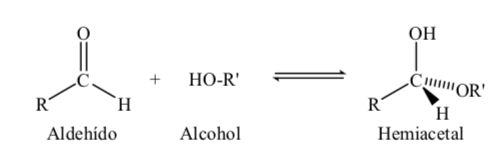
Gli zuccheri con 5 e 6 atomi di carbonio acquisiscono una struttura ciclica quando si forma un legame emiacetale per reazione del carbonile (zucchero aldeide o chetone) con un gruppo idrossile.
La reazione di formazione dell'emiacetale può essere schematizzata come segue:
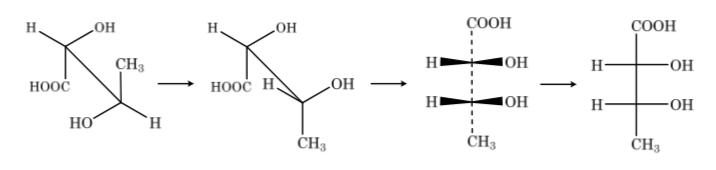
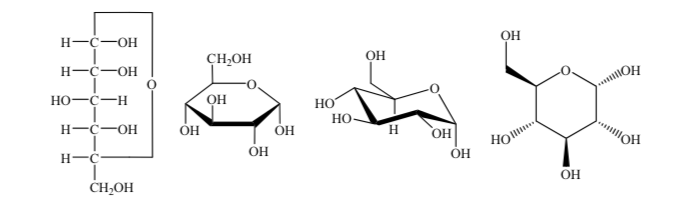
Per il loro studio, gli zuccheri sono rappresentati da strutture lineari che seguono le regole delle proiezioni di Fischer.
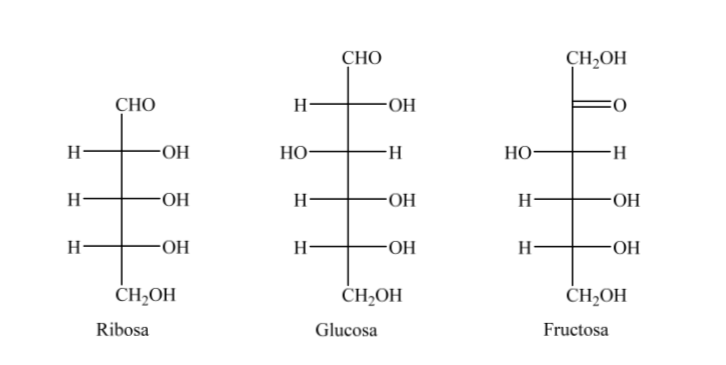
Così, ad esempio, possiamo rappresentare ribosio, glucosio e fruttosio:
Quando si forma l'emiacetale, la molecola acquisisce una disposizione curva in cui la funzione aldeidica dell'aldosio sul carbonio 1 si trova vicino all'idrossile sul carbonio 5, aggiungendosi al doppio legame carbonilico, generando l'emiacetale ciclico a sei membri (anello piranosidico ).
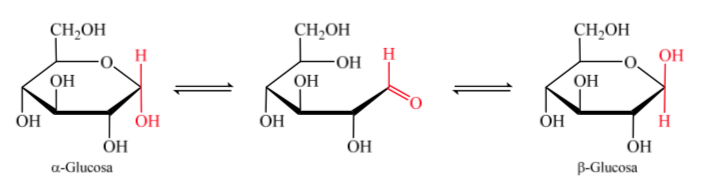
Lo stesso accade con i chetosi, ma in questo caso il legame emiacetalico si verifica tra il carbonio 2 e il carbonio 5, formando un anello a cinque membri. (anello furanosidico).
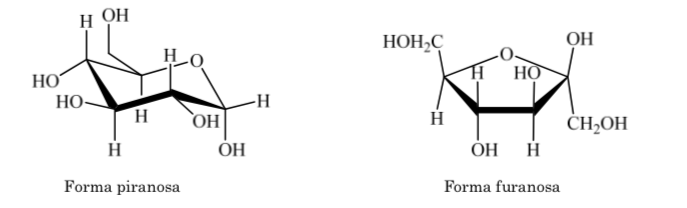
Vengono utilizzati diversi modi di rappresentare la struttura del glucosio in forma ciclica:
anomeri
Gli isomeri dei monosaccaridi con più di 5 atomi di carbonio che hanno sviluppato un legame emiacetalico sono chiamati anomeri, che ha permesso loro di assumere una struttura ciclica e determinare 2 diverse posizioni per il gruppo ossidrile (α o β) nel nuovo centro creato. .
L'anello piranosico dovrebbe essere simile a quello del cicloesano ed esistere nella conformazione a sedia piuttosto che nella conformazione a barca a torsione per ridurre al minimo le sollecitazioni torsionali. L'analisi a raggi X mostra che queste ipotesi sono corrette.
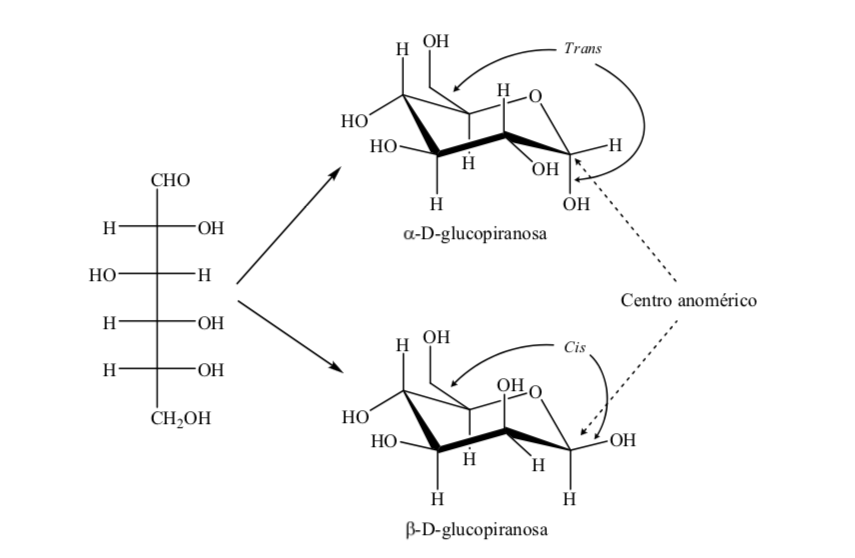
I due anomeri sono designati anomeri alfa (α) o beta (β), secondo la relazione configurazionale tra il centro anomerico e l'atomo di riferimento anomerico. Il centro anomerico si trova sul carbonio emiacetale ed è il carbonio anomerico C-1, che è legato attraverso l'ossigeno a C-5, che è legato all'ossigeno emichetale.
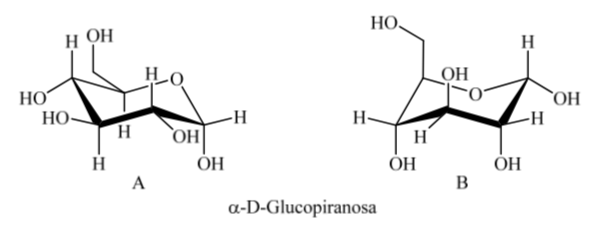
Esistono, tuttavia, due possibili conformazioni a sedia per lo stesso anomero D-(+)-glucopiranosio.
Quindi, per il β-D-(+)-glucopiranosio ci sono due possibili conformazioni. Quello che presenta i gruppi più voluminosi in equatoriale (A) sarà più stabile.
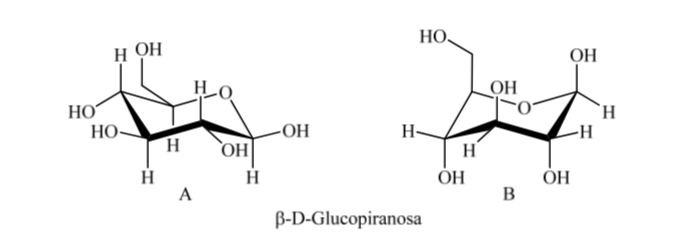
Cosa succede per l'α-D-(+)-glucosio? In questo caso la conformazione più stabile è quella in cui l'OH sul carbonio anomerico è assiale ei gruppi voluminosi sono equatoriali (A).
È interessante notare che di tutti i D-aldoesosi, solo il β-D-(+)-glucopiranosio può assumere una conformazione in cui ognuno dei suoi grandi gruppi può occupare una posizione equatoriale. Ciò è coerente con il fatto che il β -D-(+)-glucopiranosio è lo zucchero con la più alta presenza in natura.
effetti elettronici
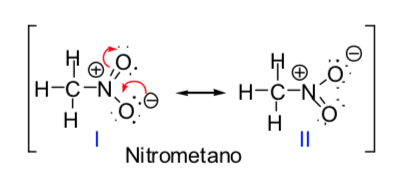
Alcune molecole organiche possono essere rappresentate da due o più strutture di Lewis, che differiscono l'una dall'altra solo per la disposizione degli elettroni e sono chiamate strutture s-risonanti. In questi casi, la molecola avrà caratteristiche di entrambe le strutture e si dice che la molecola sia un ibrido di risonanza delle strutture risonanti. Il metodo della risonanza permette di conoscere, in modo qualitativo, la stabilizzazione che una molecola può ottenere mediante delocalizzazione elettronica. Maggiore è il numero di strutture risonanti con cui una specie chimica può essere descritta, maggiore è la sua stabilità.
Il concetto di strutture risonanti può essere applicato nella descrizione del nitrometano, che può essere rappresentato dalle due strutture di Lewis riportate di seguito:
Legami coniugati e loro energia
Analisi conformazionale dell'aromaticità
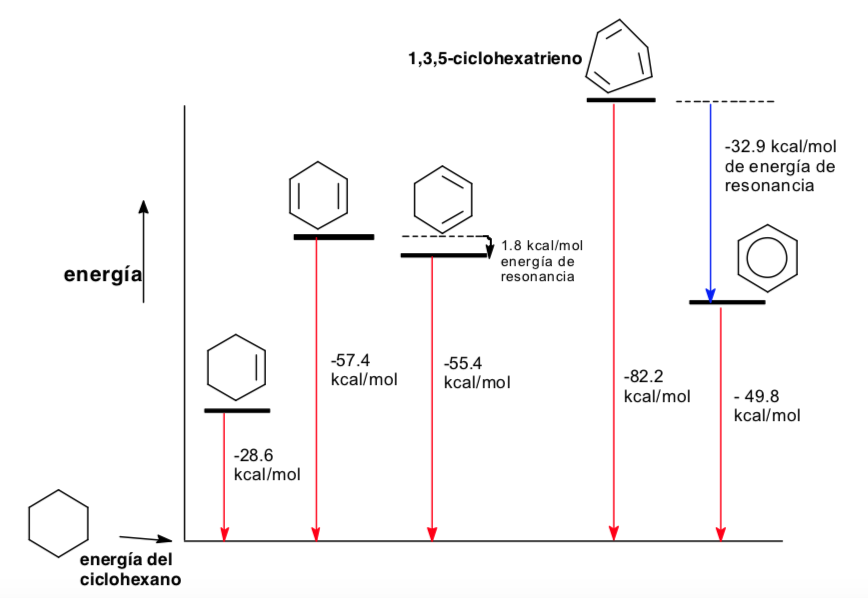 Termodinamica e analisi conformazionale (effetti stereoelettronici)
Termodinamica e analisi conformazionale (effetti stereoelettronici)
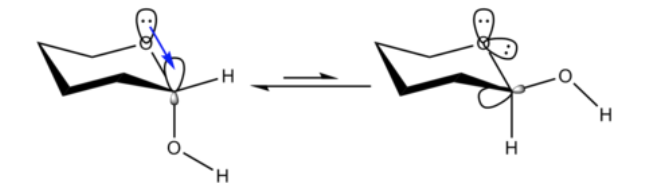
Non è inaspettato che il sostituente metossi su un anello cicloesano preferisca adottare la conformazione equatoriale.
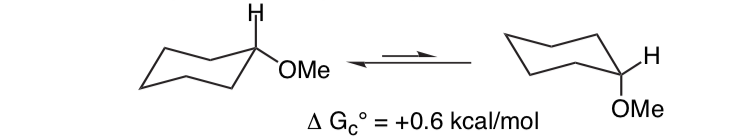
Ciò che è inaspettato è che il 2-metossitetraidropirano ClHO, strettamente correlato, preferisce la conformazione assiale:
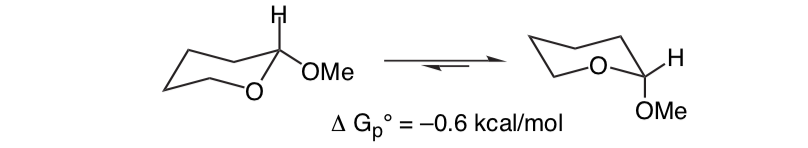
Questo effetto che fornisce la stabilizzazione dell'O-shaper assiale che abroga la distorsione sterica intrinseca del sostituente è chiamato effetto anomerico.
La relazione dell'energia libera rispetto all'effetto anomerico sarebbe la seguente:
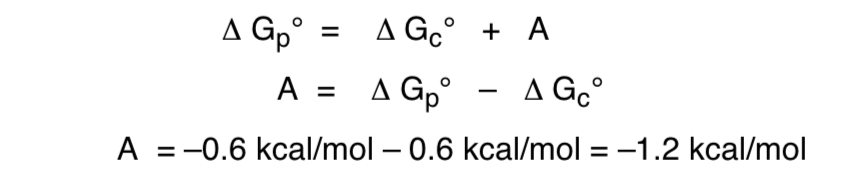
Fonti consigliate per ampliare la ricerca:
1) Juaristi E. “Concetti di base della teoria orbitale”. CINVESTAV, Messico, 1988 Juaristi E. "Fisicochimica organica". CINVESTAV, Messico, 1994.
2) Neil SI “Chimica Fisica Organica” Longman, Milano, 1995.
3) March J., “Advanced Organic Chemistry” John Wiley & Sons, New York, 1992 4) Jones RAY “Physical and Mechanistic Organic Chemistry”, 2nd. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB e Hoffmann R. “La conservazione della simmetria orbitale”, Academic Press, New York, 1979.
6) Carpenter BK “Determinazione dei meccanismi di reazione organica”, John Wiley & Sons, New York, 1984 .